2020年,这16款重磅新药或将在中国上市
本文来自微信公众号“医药魔方”。
国家药品监督管理局2019年至今已经批准了32款新药(不包括新适应症),虽然数量上远不及去年同期,但是CDE审评加速3年来,已经极大改善了新药在国内的可及性问题,而且上市时间符合条件的新药也抓住医保目录调整的机会,第一时间进入了国家医保目录,进一步减轻了国内患者的药品支出负担。
在2019年接近尾声之际,我们再来梳理一下2020年有较大希望在国内批准上市的重磅新药,供大家参考。
NO.1 恩美曲妥珠单抗(Kadcyla)
预计批准时间:2020Q1
罗氏和ImmunoGen研发的恩美曲妥珠单抗是FDA批准的第一个HER2抗体偶联药物,用于单药治疗接受过曲妥珠单抗和/或紫杉醇的晚期转移性HER2+乳腺癌。
恩美曲妥珠单抗由曲妥珠单抗与细胞毒性化合物DM1通过硫醚连接得到,恩美曲妥珠单抗结合HER2后会触发受体介导的内吞,当抗体部分被溶酶体降解后释放出DM1,杀伤肿瘤细胞。
在复发转移性HER2阳性乳腺癌患者中开展的EMILIA研究结果显示,曲妥珠单抗 vs 拉帕替尼+卡培他滨组合显示出了中位无进展生存期方面的优势(9.6 vs 6.4个月)。
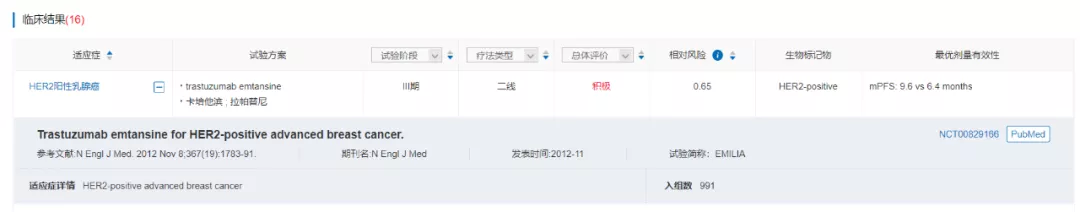
来源:医药魔方NextPharma--临床结果
恩美曲妥珠单抗在2019年3月提交了新药上市申请(JXSS1900012,JXSS1900013),并于7月纳入优先审评审批程序,目前经历了1轮发补,预计2020Q1获批。
NO.2 泽布替尼(Brukinsa )
预计批准时间:2020Q1
百济神州(06160)研发的泽布替尼是第一个对外周血细胞实现100%占据的BTK抑制剂,其对BTK的选择性比依鲁替尼更高。2019年11月14日,经FDA批准用于套细胞淋巴瘤的治疗。

泽布替尼结构式
在针对套细胞淋巴瘤的II期临床试验(BGB-3111-206)中,ORR达到84%,其中CR为59%,PR为25%。针对慢性淋巴细胞白血病和小淋巴细胞性淋巴瘤的II期临床试验(BGB-3111-205)结果显示,主要终点ORR为84.6%,其中CR为3.3%,PR为59.3%,淋巴细胞增多的PR为22%。

来源:医药魔方NextPharma--临床结果
泽布替尼在中国提交了治疗套细胞淋巴瘤、慢性淋巴细胞白血病和小淋巴细胞性淋巴瘤的上市申请(CXHS1800024,CXHS1800030),均被纳入特殊审批和优先审评审批程序,经历了2轮发补,预计2020Q1获批用于治疗套细胞淋巴瘤。
NO.3 曲美替尼/达拉非尼(Mekinist/Tafinlar)
预计批准时间:2020Q1
曲美替尼和达拉菲尼均由GSK研发,在2015年转移给诺华(NVS.US)。两种药物均靶向RAS-RAF-MEK-ERK信号转导通路,其中曲美替尼是首个获批上市的MEK抑制剂,达拉菲尼是一种BRAF抑制剂。
曲美替尼/达拉非尼组合最早于2013年5月在美国获批上市,目前获批的适应症包括黑素瘤、非小细胞肺癌和甲状腺未分化癌,也是FDA批准的唯一一个针对BRAF V600E突变阳性非小细胞肺癌的靶向疗法。
在针对BRAF V600E突变阳性非小细胞肺癌初治患者的II期临床试验(BRF113928)中,曲美替尼/达拉非尼组合的ORR达到64%。
2018年,该组合的销售额达到11.6亿美元。曲美替尼/达拉非尼组合于2019年1月提出上市申请,并于3月被纳入优先审评审批程序,目前处于一轮发补阶段,预计2020Q1获批。
NO.4 阿加糖酶β(Fabrazyme)
预计批准时间:2020Q1
阿加糖酶β由赛诺菲子公司Genzyme研发,并于2001年最先在欧洲上市,2003年在美国上市,作为酶替代疗法,用于治疗法布瑞氏症。
法布瑞氏症是一种罕见的遗传病,患病率预计达到1/40,000。由于编码α-半乳糖苷酶A(α-Gal-A)的基因突变,导致α-Gal-A不足,三聚己糖神经酰胺(GL-3)的正常降解受阻,未降解的底物在多种组织的细胞溶酶体中堆积,造成相关组织的功能障碍。目前主要采用酶替代疗法进行治疗。
近年来,阿加糖酶β的销售额稳步上升,2018年销售额为7.6亿欧元。在中国,阿加糖酶β被列入临床急需境外新药名单,其上市申请(JXSS1800021,JXSS1800022)于2019年1月被纳入优先审评程序,目前处于1轮发补阶段,预计2020Q1获批,有望成为国内首个针对法布瑞氏症的药物。
NO.5 恩莎替尼
预计批准时间:2020Q1
恩莎替尼是由贝达研发的第二代ALK抑制剂,用于接受过克唑替尼治疗或对克唑替尼不耐受的ALK阳性局部晚期或转移性非小细胞肺癌患者。
ALK融合基因在 NSCLC 患者中的阳性率约为3-8%,目前中国已经上市的ALK抑制剂包括克唑替尼、塞瑞替尼和阿来替尼,均被纳入国家医保。
II期临床试验(NCT03215693)结果显示,恩沙替尼整体 ORR 为 52.6%,中位 PFS 为 11.2 个月。恩沙替尼于2018年12月提交了上市申请(CXHS1800045,CXHS1800046),并被纳入特殊审批和优先审评审批程序,目前正在审评中,预计2020Q1获批。
NO.6 拉那芦人单抗(Takhzyro)
预计批准时间:2020Q1
拉那芦人单抗是一种靶向血浆激肽释放酶(KLK)的单抗,由武田的子公司Dyax Corp研发,用于治疗遗传性血管性水肿,在美国获得突破性疗法认定,并于2018年8月获得FDA批准上市。
遗传性血管性水肿是以发作性、自限性、局限性全身皮肤黏膜下非凹陷性水肿为特征的原发性补体缺陷病,被纳入我国《第一批罕见病目录》,最常见的原因是编码C1-INH的基因缺陷或突变,C1-INH是血液中激肽释放酶的主要生理抑制剂,激肽释放酶失控会导致水肿,发病率大约为每10,000-50,000人1例。
拉那芦人单抗在中国没有开展临床试验,于2019年3月直接提交进口新药上市申请(JXSS1900011),目前正在审评中,预计2020Q1获批。
NO.7 奥美替尼
预计批准时间:2020Q2
豪森研发的奥美替尼是一种EGFR T790M抑制剂,主要的适应症为EGFR T790M突变的非小细胞肺癌。非小细胞肺癌患者经第一代或第二代EGFR抑制剂治疗后,大约60%的患者在疾病进展时存在EGFR T790M突变。
在对第一代EGFR抑制剂耐药的晚期非小细胞肺癌患者中开展的 II期临床试验(NCT02981108)中,受试者的ORR达到66.1%。

来源:医药魔方NextPharma--临床结果
奥美替尼于2019年4月提交了上市申请(CXHS1900011),随后被纳入特殊审批和优先审评审批程序,目前处于1轮发补阶段,预计2020Q2获批,有望成为首个国产的三代EGFR抑制剂。
NO.8 维布妥昔单抗(Adcetris )
预计批准时间:2020Q2
维布妥昔单抗是目前唯一一个上市的靶向CD30的抗体偶联药物,由武田研发,2011年在美国上市,是近40年来FDA批准的第一个间变性大细胞淋巴瘤新药,也是第一个针对经典型霍奇金淋巴瘤和外周T细胞淋巴瘤的一线治疗药物。
全球每年大约有62,000例患者被诊断为霍奇金淋巴瘤,其中经典型霍奇金淋巴瘤占到95%。在一项针对III/IV期霍奇金淋巴瘤初治患者的ECHELON-1研究中,维布妥昔单抗联合多柔比星、长春碱、达卡巴嗪与博来霉素联合多柔比星、长春碱、达卡巴嗪进行对比,受试者的2年无进展生存率明显提升(82.1% vs 77.2%),降低了患者的疾病进展和死亡风险(HR为0.77,P=0.04)。
维布妥昔单抗于2019年4月申请上市(JXSS1900015),在6月被纳入优先审评审批程序,目前还在审评中,预计2020Q2获批。
NO.9 维多珠单抗(Entyvio)
预计批准时间:2020Q2
维多珠单抗是一种α4β7整合素单抗,能够特异性结合α4β7整合素,阻断α4β7与黏膜地址素细胞粘附分子-1(MAdCAM-1)的相互作用,是第一个也是唯一一个专门针对肠道炎症信号通路的药物。维多珠单抗由武田研发,最早于2014年在美国上市,获批的适应症为溃疡性结肠炎和克罗恩病。
在全球首个针对溃疡性结肠炎的生物制品头对头III期VARSITY临床试验中,维多珠单抗对比阿达木单抗显示出优效性,主要终点临床缓解率为31.3% vs 22.5% (p=0.0061),且安全性更好。
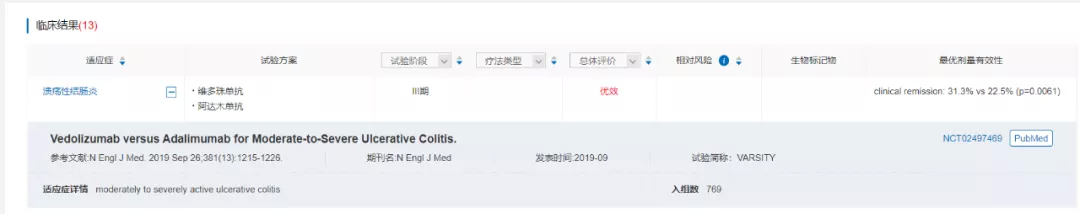
来源:医药魔方NextPharma--临床结果
2018年,维多珠单抗的销售额约为25亿美元。2018年11月,维多珠单抗被纳入第一批临床急需境外新药名单。2019年6月,维多珠单抗的上市申请(JXSS1900032,JXSS1900033)被CDE承办,目前还在审评中,预计2020Q2获批。
NO.10 古塞库单抗(Tremfya)
预计批准时间:2020Q2
强生(JNJ.US)的古塞库单抗是第一个获批的IL-23单抗,通过选择性抑制IL-23的p19亚基而非p40亚基可以更完全地抑制IL-23的活性,于2017年7月在美国获批上市,同年11月在欧洲上市,用于治疗斑块状银屑病和银屑病关节炎。
在治疗斑块状银屑病的头对头III期临床试验(ECLIPSE)中,古塞库单抗与司库奇尤单抗(IL-17A单抗)48周的PASI90应答率分别为为84%vs 70%(p<0.0001),显示出长期治疗的优效性。在针对银屑病关节炎的III期DISCOVER-2临床试验中,与基础治疗相比,ACR20为64.1% vs 32.9% (p<0.001),且耐受性良好。
古塞库单抗的2018年全球销售额为5.4亿美元,预计未来会迅速增长。该药被纳入第一批临床急需境外新药名单,2019年6月提交上市申请(JXSS1900035),目前在审评中,预计2020Q2获批。
NO.11 布罗舒单抗(Crysvita)
预计批准时间:2020Q2
布罗舒单抗由Ultragenyx Pharmaceutical和Kyowa Hakko Kirin共同开发,2018年于美国和欧洲获批用于X-连锁低磷酸盐血症(XLH)的治疗,是第一个获批上市的FGF23单抗。
XLH一种罕见的遗传性,进行性和终生性的骨骼疾病,由PHEX基因突变引起,PHEX失去功能导致FGF23水平升高,肾脏磷重吸收不足,进而引起低血磷,在发达国家约有48,000例患者。
布罗舒单抗是目前唯一一个针对XLH的治疗药物,曾被FDA授予突破性疗法。XLH在我国尚无有效治疗方案,2019年5月,布罗舒单抗被纳入第二批临床急需境外新药名单。2019年8月,布罗舒单抗的上市申请被CDE承办,目前在审评中,预计2020Q2获批。
NO.12 氯化镭[223Ra] (Xofigo)
预计批准时间:2020Q3
氯化镭“223Ra”由拜耳研发,2013年5月在美国获批上市,用于治疗晚期去势抵抗前列腺癌的骨转移。氯化镭“223Ra”是FDA批准的唯一一个α粒子放射治疗药物,通过与骨骼中的羟基磷灰石形成复合物,选择性地靶向骨骼,尤其是骨转移区域,产生强效的细胞毒效应。
骨转移常见于实体瘤患者,特别是前列腺癌、乳腺癌和肺癌。大约90%的转移性前列腺癌存在骨转移,骨转移导致骨相关事件增加,这是去势抵抗前列腺癌的主要致死原因。在III期 临床试验(ALSYMPCA)中,在最佳支持治疗的基础上Xofigo相比安慰剂可使中位总生存期延长3.6个月(14.9 vs 11.3个月)。
氯化镭[223Ra]在2018年的销售额为3.5亿欧元。该药曾在2018年11月提交上市申请,但未获批准,2019年8月再次提交上市申请(JXHS1900109),并被纳入优先审评审批程序,目前正在审评中,预计2020Q3获批。
NO.13 氟唑帕利
预计批准时间:2020Q3
全球每年有大约100万例女性被诊断为乳腺癌或卵巢癌,其中5%-10%存在BRCA1或BRCA2胚系突变。氟唑帕利是恒瑞研发的一种聚腺苷二磷酸核糖聚合酶(PARP)抑制剂,可特异性杀伤BRCA突变的肿瘤细胞,主要适应症为卵巢癌和乳腺癌。
在既往经过二线及以上化疗的伴有BRCA1/2致病性或疑似致病性突变的复发性卵巢癌患者中开展的II期临床研究(NCT03509636)结果显示,受试者的ORR和DCR分别为64.1% 和95.1%,超过预设,毒性可耐受。

来源:医药魔方NextPharma--临床结果
基于II期临床试验的结果,恒瑞在2019年10月向NMPA提交了上市申请(CXHS1900033),并被纳入特殊审批程序,目前正在审评中,预计2020Q3获批。目前全球已上市的PARP抑制剂有4个,氟唑帕利作为国内进展最快的同类药品倍受关注。
NO.14 倍林妥莫双抗(Blincyto)
预计批准时间:2020Q4
倍林妥莫双抗 (blinatumomab) 是Amgen开发的靶向CD3和CD19的双特异性抗体,2014年12月率先在美国获批上市,是全球首个获批用于急性淋巴细胞白血病的双特异性抗体。
倍林妥莫双抗由两段scFv串联形成,药物血浆半衰期短,每个治疗疗程需要持续静脉给药28天。III期TOWER研究( NCT02013167)数据显示,倍林妥莫双抗相比化疗可延长中位生存期3.7个月(7.7 vs 4.0个月),给急性淋巴细胞白血病患者带来显著总生存期获益(HR 0.71,P=0.01)。
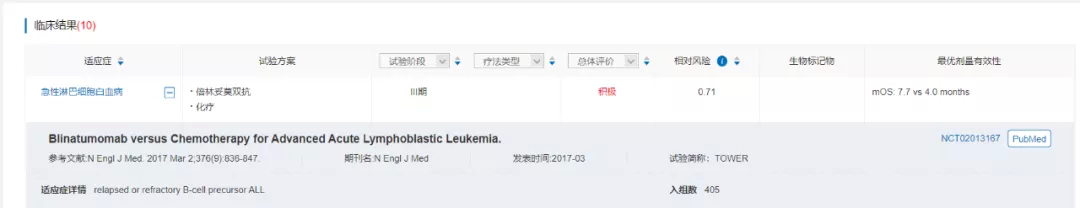
来源:医药魔方NextPharma--临床结果
2019年10月,倍林妥莫双抗向NMPA提交上市申请(JXSS1900060),目前处于技术审评阶段,预计2019Q4中国获批上市。
NO.15 泰它西普
预计批准时间:2020Q4
泰它西普是由荣昌生物研发的TACI-Fc融合蛋白,能够同时抑制BLyS和APRIL两个B淋巴细胞分化成熟关键因子,阻断B淋巴细胞的分化成熟,抑制过度的免疫反应,目标适应症为系统性红斑狼疮、类风湿性关节炎和视神经脊髓炎等。
在一项针对系统性红斑狼疮的II期临床(NCT02885610)中,泰它西普高剂量组48周应答率达到79.2%,安慰剂对照组应答率为32.0%,治疗效果显著,而且耐受性良好。
系统性红斑狼疮是一种累及全身多系统的自身免疫性疾病,全球患病人数约为800万,在中国发病率为70/100,000,近60年来仅有贝利尤单抗一款新药获批上市,泰它西普是一种潜在的best in class治疗药物。2019年11月,泰它西普申请上市(CXSS1900040),并被纳入特殊审批和拟优先审评审批程序,预计2020Q4获批。
NO.16 索凡替尼
预计批准时间:2020Q4
和黄医药(HCM.US)研发的索凡替尼是一种靶向CSF-1R、VEGFR和FGFR1的多靶点抑制剂,目前开发进度最快的适应症是神经内分泌瘤。神经内分泌瘤(NET)起源于与神经系统相互作用的细胞或产生激素的腺体,大约55%-75%源于胃肠胰,25%-30%源于肺和支气管,10%-20%源于其他组织,2018年中国新诊断病例数约为67,600例。
2019年6月,和黄医药宣布以晚期非胰腺神经内分泌瘤为适应症的III期临床研究(SANET-ep)中期分析达到主要终点并将提前终止。11月,索凡替尼向NMPA提交了新药上市申请(CXHS1900034),目前正在审评中,预计2020Q4获批。
(编辑:张金亮)




 扫码下载智通APP
扫码下载智通APP