再鼎医药(ZLAB.US)5款抗癌药获批临床,针对胃癌、肝癌等多种癌种!
本文来自微信公众号“医药观澜”。
中国国家药监局药品审评中心(CDE)网站最新数据显示,再鼎医药(ZLAB.US)有五款药物在中国获得临床试验默示许可,包括:PD-1单抗INCMGA00012注射液、HER2单抗margetuximab注射液、PD-1/ LAG-3双特异性抗体MGD013注射液、PARP抑制剂尼拉帕利胶囊、激酶抑制剂丙氨酸布立尼布片,涉及非小细胞肺癌(NSCLC)、胃癌、晚期肝癌、乳腺癌等多种适应症。
这5款产品均是再鼎医药从其它公司引进,除了尼拉帕利,其余4款产品尚未在中国获批。
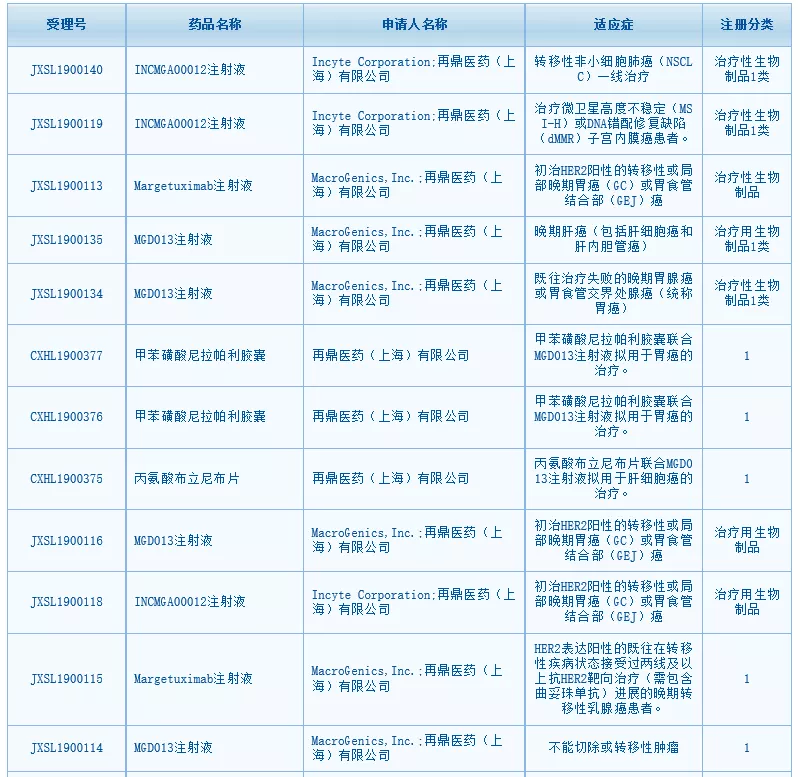
图片来源:CDE官网截图
1、INCMGA00012注射液
INCMGA0012是MacroGenics公司开发的一款处于试验阶段的抗PD-1单克隆抗体,MacroGenics公司在2017年10月将INCMGA0012的全球权利授权给了Incyte公司,但保留了使用INCMGA0012开发产品管线的权利。2019年7月,再鼎医药又通过与Incyte签订协议,获得了该药在大中华区(中国大陆、香港、澳门和台湾地区,下同)的独家开发和商业化授权许可。
本次INCMGA0012在中国获批三项临床试验申请,涉及三个适应症:一线治疗转移性NSCLC、治疗微卫星高度不稳定(MSI-H)或DNA错配修复缺陷(dMMR)子宫内膜癌患者、初治HER2阳性的转移性或局部晚期胃癌或胃食管结合部癌。
2、Margetuximab注射液
Margetuximab是MacroGenics公司研发的一款靶向人表皮生长因子受体2(HER2)的单克隆抗体药物。HER2在乳腺癌、胃食管癌和其他实体瘤中均有表达。2018年11月,再鼎医药与MacroGenics公司达成合作,获得了margetuximab在大中华区的开发及商业化独家授权。
目前,margetuximab正在进行多个临床试验。2019年10月25日,margetuximab针对胃癌或胃食管结合部癌患者的2/3期临床研究MAHOGANY已完成首位患者给药。本次,margetuximab在中国获得两项临床试验申请,包括两项适应症:初治HER2阳性的转移性或局部晚期胃癌或胃食管结合部癌、HER2表达阳性的既往在转移性疾病状态接受过两线及以上抗HER2靶向治疗(需包含曲妥珠单抗)进展的晚期转移性乳腺癌患者。
3、MGD013注射液
MGD013是MacroGenics公司利用DART®平台开发的首个能够同时与表达在T淋巴细胞表面的免疫检查点分子PD-1和淋巴细胞活化基因3(LAG-3)相结合的双特异性抗体。MGD013在血清中的半衰期很长,通过同时阻断这两个免疫检查点分子的免疫抑制,具有治疗多种实体瘤和恶性血液肿瘤的潜力。
2018年11月,再鼎医药与MacroGenics公司达成合作,获得了MGD013在大中华区的独家开发及商业化授权。MGD013本次在中国获批四项临床试验,针对晚期肝癌、既往治疗失败的晚期胃癌、初治HER2阳性的转移性或局部晚期胃癌或胃食管结合部癌、以及不能切除或转移性肿瘤四种适应症。
4、尼拉帕利胶囊
尼拉帕利是由葛兰素史克旗下Tesaro公司开发的一款口服PARP1/2抑制剂,再鼎医药于2016年9月获得了该药在中国市场的独家研发和销售权。尼拉帕利已于2018年10月、2019年6月、2019年12月相继在中国香港、中国澳门和中国大陆获批上市。
尼拉帕利在中国大陆获批的适应症为——作为对含铂化疗完全或部分缓解的复发性上皮性卵巢癌、输卵管癌或原发性腹膜癌成人患者维持治疗,是再鼎医药在中国大陆获批上市的首款产品。尼拉帕利本次获批的两项临床试验申请针对的是:联合PD-1/ LAG-3双特异性抗体MGD013注射液拟用于胃癌的治疗。
5、丙氨酸布立尼布片
布立尼布(brivanib)是百时美施贵宝公司开发的一种口服的激酶抑制剂,再鼎医药于2015年3月获得了该药在中国大陆、香港和澳门的开发、生产和商业推广权利。布立尼布本次在中国获得一项临床试验申请,适应症为联合PD-1/ LAG-3双特异性抗体MGD013注射液拟用于肝细胞癌的治疗。
我们祝贺再鼎医药的上述产品在中国获批临床,希望这些药物临床研究顺利进行,并取得好的结果,早日惠及患者!(编辑:孟哲)




 扫码下载智通APP
扫码下载智通APP