国产生物类似药爆发了!近 2 年已有 16 个报产,离集采还远吗?
本文转自微信公号“Insight数据库”,作者:丁音
自 2019 年 2 月,复宏汉霖(02696)首个国产生物类似药“利妥昔单抗注射液”(商品名:汉利康)获批上市后,国内生物类似药研发热火朝天,近期进入密集获批阶段。
据 Insight 数据库统计,自 2018 年 6 月至今,先后有 16 个国产生物类似药递交上市申请;首个国产生物类似药之后,又有 5 款以原研为参照药、按照生物类似药途径研发和申报生产的产品。
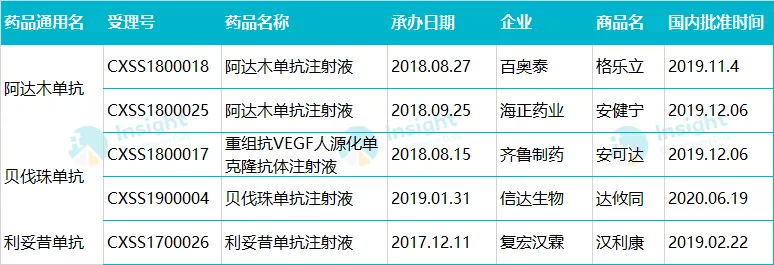
此外,复宏汉霖的首个国产利妥昔单抗生物类似药也即将获批;值得注意的是,近日三生国健自主研发的抗 HER2 单抗(依尼妥珠单抗)获批上市,与曲妥珠单抗同靶点,适应症为联合化疗治疗 HER2 阳性转移性乳腺癌。
全球畅销生物药在中国市场的表现
近两年,在临床市场刚需的推动下,全球生物类似物的研发异常火热,生物类似药俨然成为药企的必争之地。2020 年,全球大批原研生物药将在专利到期,这对原研生物类似物的研发迎来重要发展机遇,未来我国越来越多的生物类类似药也将批准上市。随着大量生物类似物的陆续上市,使得相关药物的市场可及性得到极大提升。
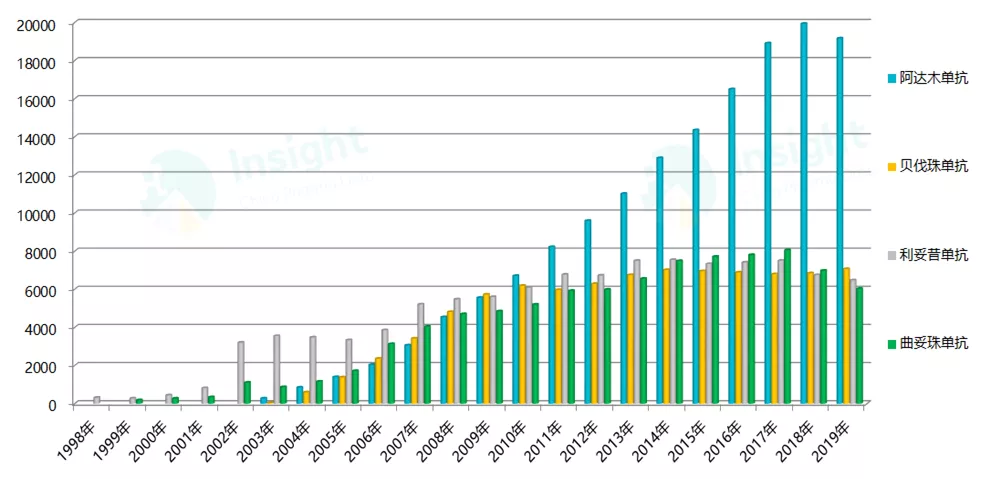
公开数据显示,2019 年全球阿达木单抗、贝伐珠单抗、利妥昔单抗、注射用曲妥珠单抗 4 款畅销药物销售总额达 387.6 亿美元,较同期下降 4.3%。
图 1:1998-2019 年全球 4 款单抗市场销售情况(单位:百万美元)
2019 年据国内样本医院数据显示,阿达木单抗,贝伐珠单抗,利妥昔单抗,曲妥珠单抗 4 款畅销药物销售总额已近 50 亿元,较同期增长近 40%。
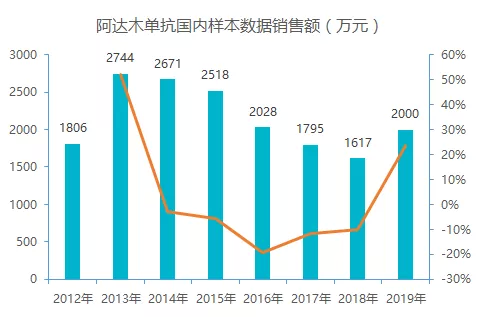
图 2:2012-2019 年国内样本数据 4 款单抗市场销售情况(单位:万元)
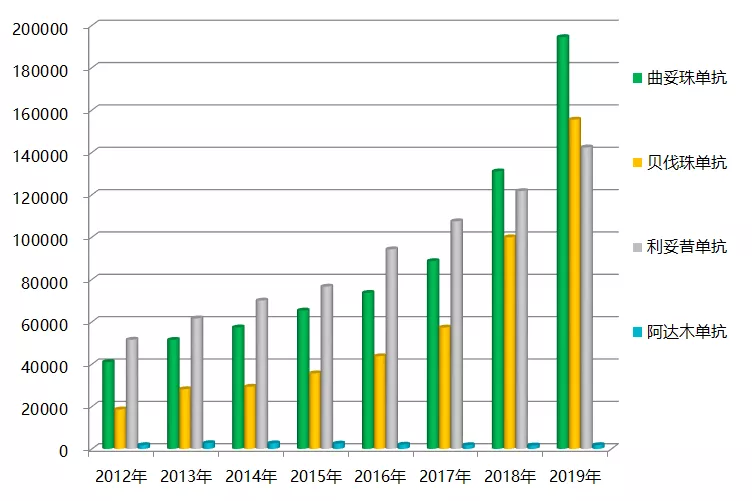
全球 4 款产品除了贝伐珠单抗呈增长态势以外,其它三款呈下降态势;而国内 4 款药物除了阿达木单抗表现平平以外,其它三款贝伐珠单抗,利妥昔单抗,曲妥珠单抗呈高增长态势。
阿达木单抗国内已满 3 家(2+1)
阿达木单抗由美国艾伯维(AbbVie)公司开发,商品名为「Humira」。该产品是全球首个获批准的抗炎性细胞因子肿瘤坏死因子(TNF)α的全人源重组人 IgG1 单克隆抗体,可以减少自身免疫疾病的炎症反应,于 2003 年 1 月首次上市用于类风湿性关节炎。之后,修美乐的适应症扩展到其他自身免疫疾病,包括银屑病关节炎、强直性脊柱炎、克罗恩病、银屑病、青少年特发性关节炎和溃疡性结肠炎,未来适应症还将继续拓宽。
公开数据显示,Humira 自 2012-2019 年连续 8 年全球畅销药排名第 1 位。该产品 2016 年 12 月面临美国专利到期,医药巨头安进、默沙东和辉瑞都在开发修美乐仿制药,自 2018 年达到销售峰值后销量开始出现下滑。
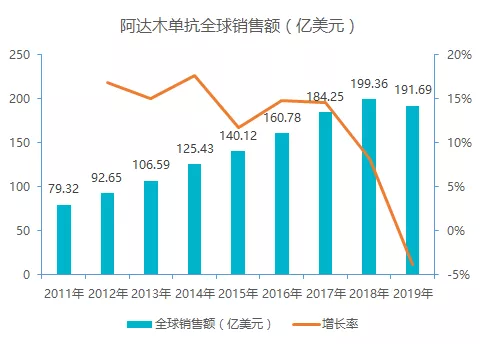
阿达木单抗由雅培公司于 2010 年在我国进口上市,商品名为「修美乐」,剂型为注射液,规格为 40 mg:0.8 ml 一种,在中国获批用于治疗类风湿性关节炎,2013 年又获批用于缓解活动性强直性脊柱炎患者的相关病征和症状。
据样本医院数据统计,修美乐在国内上市以来,增长较为缓慢,其在国内市场的销售展现出与全球市场截然不同的情况。在 2019 医保谈判过程中,修美乐降价 59% 成功进医保,后续有望迎来放量期。
目前国内众多药企正在进行阿达木单抗的「仿制」开发,目前已有百奥泰生物和海正药业获批上市;此外,信达生物(01801)、复宏汉霖、君实生物(01877)、正大天晴正在审评审批中。
贝伐珠单抗国内已满 3 家(2+1)
贝伐珠单抗是罗氏旗下基因泰克开发的重磅抗肿瘤产品,是一种重组人源化 VEGF 单抗,商品名为「Avastin」,同时也是全球第一款抗肿瘤血管生成药物。
该药于 2004 年 2 月和 2005 年 1 月相继获得 FDA 和 EMA 的批准。目前已获得结直肠癌、非小细胞肺癌、肾细胞癌、卵巢癌等多个实体瘤适应症。
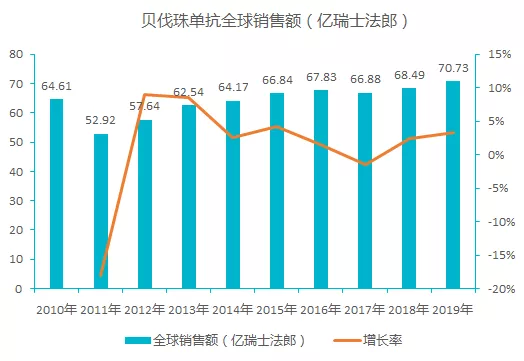
公开数据显示,贝伐珠单抗获批上市第 2 年全球销售额就突破 10 亿美元大关,截止 2019 年,贝伐珠单抗累计销售额已近 851 亿美元。该产品欧洲专利保护在 2018 年到期,美国专利保护在2019 年到期,已然成为国内外热门仿制产品。
2010 年 2 月,罗氏的贝伐珠单抗获 CFDA 批准上市,商品名为「安维汀」,主要用于治疗转移性结直肠癌和晚期、转移性或复发性非小细胞肺癌。剂型为注射液,规格为 100mg/4mL、400mg/16mL 两种。
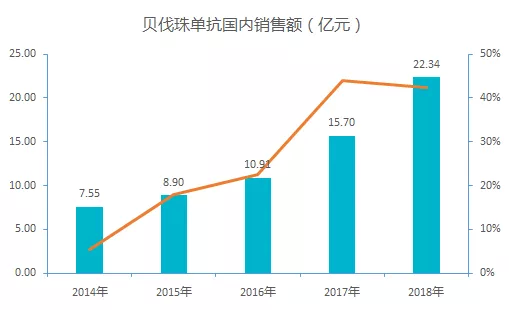
2017 年贝伐珠单抗通过谈判进入国家医保目录,降幅达 62%,随着医保政策的红利释放,贝伐珠单抗的市场快速增长十分明显,预计 2019 年国内销售额超过 30 亿元。
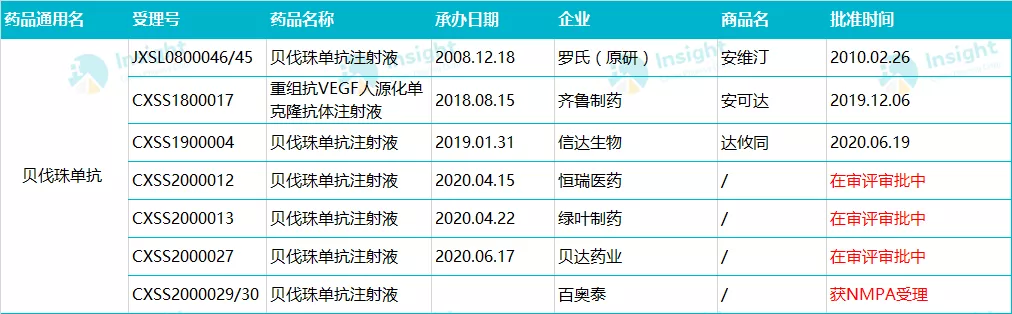
2019 年 12 月 6 日,齐鲁制药研制的贝伐珠单抗注射液获得 NMPA 批准上市,商品名为「安可达」。安可达是国内获批的首个贝伐珠单抗生物类似药,主要用于晚期、转移性或复发性非小细胞肺癌、转移性结直肠癌患者的治疗。2020 年 6 月 19 日,信达生物贝伐珠单抗注射液获得 NMPA 批准上市,用于非鳞状非小细胞肺癌和转移性结直肠癌,成为了第二款在中国获批上市的贝伐珠单抗生物类似药。
Insight 数据库显示,国内贝伐珠单抗类似药的研发竞争中,申报企业已达 20 多家。除齐鲁制药、信达生物获得批准上市以外,恒瑞医药、绿叶制药、贝达药业贝伐珠单抗生物类似药正在审评审批中。
随着国内贝伐珠单抗生物类似物的陆续上市,中国贝伐珠单抗生物类似药的市场潜能将进一步激发,国内肿瘤患者在贝伐珠单抗这一药物上的支付压力将会进一步减轻。
曲妥珠单抗国内满 2 家
曲妥珠单抗是由罗氏公司旗下基因泰克公司研发, 于 1998 年获得 FDA 批准,商品名为「Herceptin」,是用于治疗 HER2 过度表达的转移性乳腺癌的药物。该产品自问世以来,不仅明显改善了转移性乳腺癌患者预后,也极大提高了早期乳腺癌辅助化疗患者的无病生存率和总生存。
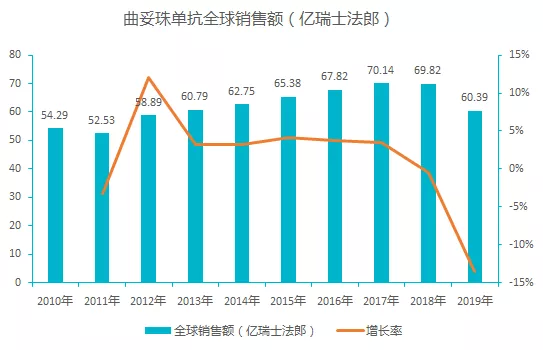
该品种为罗氏旗下王牌药品,长期占据了药物销售 TOP10 的名单,最早于 1998 年 9 月 25 日获得美国 FDA 批准上市。自上市以来,销量稳步增长,但是由于专利期的到来,2018 年之后销售额逐渐下滑, 2019 年全球销售额近 60 亿瑞士法郎,同比下降 13.5%。
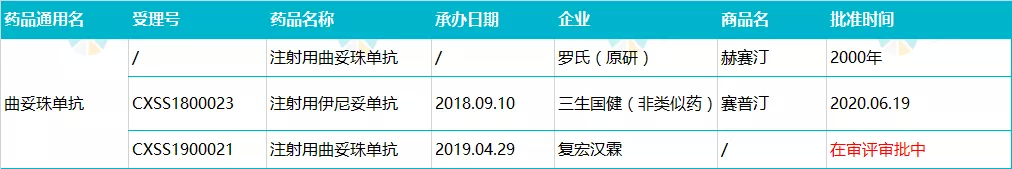
罗氏曲妥珠单抗于 2002 年获得 CFDA 批准进口,商品名为」 赫赛汀」, 适应证为 HER2 过度表达的转移性乳腺癌、HER2 过度表达的转移性胃腺癌或胃食管交界腺癌。国内获批剂型为粉针剂,规格有 440 mg、150 mg 两种。
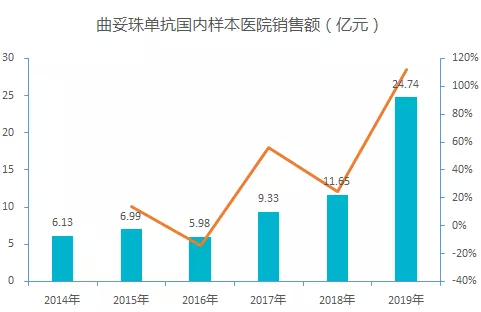
在国内,赫赛汀于 2002 年获批进口,一直保持缓慢增长。2017 年赫赛汀纳入医保后,由原本每瓶 21613 元降价至 7600 元,降价幅度达 65%,后续市场需求进一步被打开。公开数据显示,2019 年,赫赛汀在国内样本医院的销售额约 25 亿元,增速显著加快。
截止目前,国内 HER2 抗体新药已申报 23 家, HER2 阳性乳腺癌领域的竞争可谓极其激烈。除三生国健同靶点的新单抗获得批准上市以外,复宏汉霖的曲妥珠单抗生物类似药正在审评审批中,预计即将获批。
利妥昔单抗国内满 2 家(1+1)
利妥昔单抗由美国罗氏公司开发,商品名为「Rituxan」,是一种靶向 CD20 的鼠/人嵌合的单克隆抗体,也是全球第一个被批准用于临床治疗非霍奇金淋巴瘤(NHL)的单克隆抗体。
该药最早在 1997 年获得 FDA 的批准用于早期淋巴瘤的治疗,具有毒副作用较小的优点,应用于早期淋巴瘤患者的临床试验结果非常显著。此后,癌症靶向药物陆陆续续在美国批准上市。虽然利妥昔单抗市场潜力巨大,但也面临专利到期威胁。
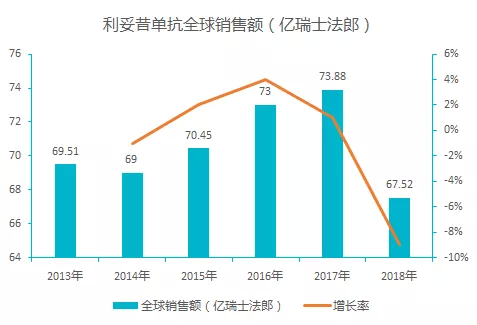
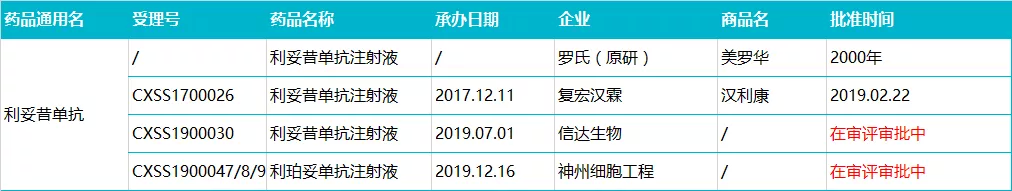
利妥昔单抗由美国罗氏于 2000 年在我国进口上市,商品名为「美罗华」,剂型为注射液,规格为 100 mg/10 ml、500 mg/50 ml 两种,在中国批准非霍奇金淋巴瘤适应症。
据样本医院数据统计,利妥昔单抗在国内一直保持较为稳定的增速,2019 年销售额为 14.24 亿元,较同期增长 16.9%。
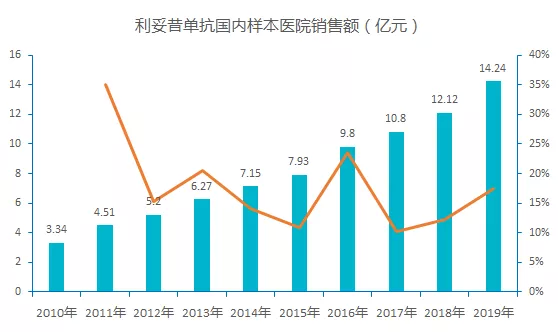
2019 年 2 月 22 日,复宏汉霖研制的利妥昔单抗注射液获得 NMPA 批准上市,商品名为「汉利康」,成为首个国产利妥昔单抗生物类似药,当年实现 1.5 亿元的销售额。
截止目前, 在利妥昔单抗类似药的研发竞争中,除了复宏汉霖外,信达生物、神州细胞工程正在审评审批中。
小结
生物制剂是当前最畅销的医药产品之一,在抗肿瘤领域获得了巨大发展。我国抗体药物虽然起步晚,但发展迅速。随着全球畅销单抗药物如阿达木单抗、贝伐珠单抗、利妥昔单抗、曲妥珠单抗等重磅抗体药的专利到期,我国生物仿制药的发展未来将能得到极大的发展,特别是在我国鼓励新药研发、生物制药研发的政策背景下,单克隆抗体类药物市场将会迎来一片繁荣景象。




 扫码下载智通APP
扫码下载智通APP