生物药“取名宝典“问世 复星医药(02196)等迎来“神助攻“

智通财经获悉,为进一步完善和规范我国生物制品通用名命名管理,使我国生物制品通用名命名原则符合生物制品的发展需要,促进我国生物制品的国际化进程,3月1日,国家药典委员会发布了关于对《生物制品通用名命名原则规程》征求意见的通知。
该征求意见稿分别对已有世界卫生组织国际非专利名称(INN)的生物制品,主要包括治疗性重组蛋白(多肽)以及尚无INN,包括疫苗、血液制品、微生态制品、诊断制品等生物制品命名原则进行详细说明。
如各大药企争先研发的单克隆抗体类。国家药典委员会要求由后缀-mab识别所有包含结合明确靶点的免疫球蛋白可变区的制品,加上来源/靶点(分子,细胞,器官)词干及前缀组成。偶联另一个蛋白或化学物质(如螯合剂)的单抗的中文INN由偶联药物的中文INN名称加单抗中文INN名称,其中偶联药物的INN中文名称应基于简短的原则采用音译、意译或音/意合译方式命名并尽可能系统反映结合药物的类
非糖基化化合物(蛋白质/肽类)则用后缀识别一组蛋白或多肽,通过一个随机的前缀来显示氨基酸链的不同,如水蛭素类似物的后缀为芦定(英文INN-irudin);或用一个单词来识别一组蛋白或多肽,通过名称中的第二个单词来显示氨基酸链的不同,如甘精胰岛素(英文INN Insulin Glargine)。
而尚无INN的疫苗等生物制品,可以疾病、微生物、特定组成成分或材料等命名。如来自人血浆分离的血液制品,其通用名由有效成分化学名称(白蛋白/免疫球蛋白/凝血因子Ⅷ/纤维蛋白原等)加剂型(注射液/注射用)和来源(人)组成,如人血白蛋白(注射液);存在不同给药途径的同类制品应在名称中注明给药途径以示区分,如静脉注射用人免疫球蛋白。重组凝血因子类参照INN命名原则进行命名。
事实上,据智通财经观察,由于现阶段我国生物类似药命名和原研药区别并不明显,使得生物类似在申报过程中难以形成鲜明特征,造成较多类似生物单抗药物通过“改名”而获得了新药身份,即对真正的单抗药物形成了冲击,也不利于类似生物药整体发展。而该征求意见稿的出台则有望改正这一现状,利好走在生物类似药研发前列的企业,如复星医药(02196)、丽珠医药(01513)。
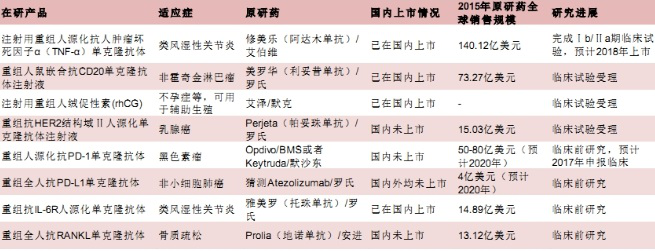
目前,复星医药重磅产品利妥昔单抗(美罗华类似药)、曲妥珠单抗(赫赛汀类似药)进度在国内处于领先地位。
数据上看,利妥昔单抗原研药2015年国内城市公立医院销售超过19亿元,2013-2015年的复合年均增长率达16.01%。而从临床申报的情况来看,虽然利妥昔单抗生物类似药的申报企业较多,有14家药企进入临床研究阶段(其中不少企业以新药来申报,将来可能受到影响),但截至目前只有复星医药进入了三期临床试验,若该生物类似药顺利通过获批上市,将为复星医药带来较大的业绩贡献。
丽珠医药当前在研的生物类似药已有10多个,涵盖抗肿瘤坏死因子-α单抗、抗CD20单抗、抗HER2单抗等潜在重磅品种。预计未来每隔1-2年,该公司便将有一个单抗上市。
目前研发进度最快的是抗TNF-α单抗,国际上自免药物仍然以抗TNF-α单抗为主,国内抗TNF-α单抗已有3家上市,虽然还有多种进口产品竞争,国产品种有望凭借价格优势抢占市场。国内产品的竞争将主要集中在企业的市场推广能力,其他几个即将进入临床的品种在国内类似药不多,且和丽珠医药进度差距不大,所以长期来看,单抗业务有望成为丽珠的支柱产业。再由于目前该股PE约21倍,估值并不算高。




 扫码下载智通APP
扫码下载智通APP