新股消息 | 北海康成 专注罕见病领域创新疗法
智通财经APP获悉,北海康成制药有限公司(CANbridge Pharmaceuticals
Inc.)不久前向港交所递交了上市申请,准备在香港上市。大摩、Jefferies为北海康成联席保荐人,投资者包括WuXi PharmaTech
Healthcare Fund I L.P.、药明生物(香港)有限公司、RA Capital Health Fund,
L.P.、杭州泰格医药科技股份有限公司等。

公司简介
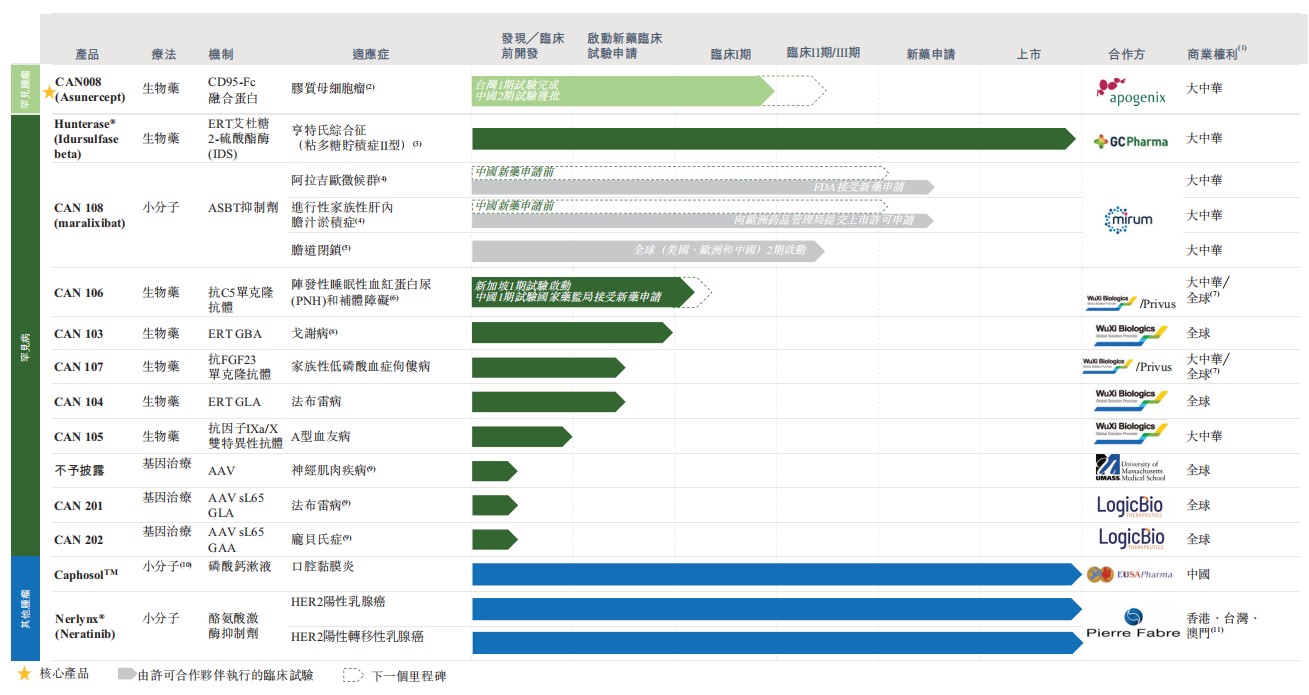
北海康成是专注于罕见病的全球领先生物医药公司,致力于研究、开发及商业化变革性的疗法。自2012年成立以来,北海康成已打造了丰富且差异化的产品管线,包含针对部分最普遍的罕见疾病以及罕见肿瘤适应症的13种极具市场潜力的药物资产,其中3种产品已上市、3种候选药物处于临床阶段,2种候选药物处于IND准备阶段、2种候选药物处于临床前阶段以及3种处于先导识别阶段的基因疗法产品。
在罕见病领域,北海康成拥有7种生物制剂及小分子候选产品,用于治疗亨特氏综合症(MPS II)及其他溶酶体贮积病(LSD)、补体介导紊乱、A型血友病、代谢紊乱,以及罕见胆汁淤积性肝病,包括Alagille综合症(ALGS)、进行性家族性肝内胆汁淤积症(PFIC)及胆道闭锁(BA)。2020年9月,随着用于治疗黏多糖贮积症二型(以下简称MPS II)的酶替代疗法(ERT)药物Hunterase®(CAN101)在国内批准上市,北海康成成为国内首个且唯一将酶替代疗法(ERT)药物投入商业化应用的医药企业。与此同时,北海康成还在新加坡健康志愿者中启动了CAN106的1期临床试验,并于2021年7月获得国家药监局的新药临床试验(IND) 批准, 用于治疗阵发性睡眠性血红蛋白尿症。此外,北海康成用于治疗戈谢病的CAN103临床试验申请(IND)已获国家药监局正式受理;
在罕见肿瘤领域,北海康成正开发的CAN008将用于治疗多形性胶质母细胞瘤(GBM)。2018年,CAN008在台湾完成了 1期临床试验,并成功与亚洲新诊断的GBM患者桥接。北海康成计划于2021年下半年在中国内地完成CAN008 2期临床试验的首例患者给药。其他两种肿瘤产品——CaphosolTM (CAN002)及Nerlynx®(CAN030)已分别在中国内地及大中华区获得了上市许可。
在基因疗法领域,北海康成使用LogicBio Therapeutics授权的AAV sL65衣壳载体,开发两种分别用于治疗法布雷病及庞贝氏病的基因治疗产品。北海康成与UMass合作,赞助开发神经肌肉疾病基因治疗方案的研究项目,并获得独家选择权。同时,公司还在内部开发靶向不同组织的腺相关病毒(AAV)递送平台,例如中枢神经系统(CNS)及肌肉疾病。
产品介绍及其商业化潜力
北海康成核心产品CAN008是一种正开发用于治疗GBM的CD95-Fc糖基化融合蛋白,并于2016年9月经台湾食品药物管理署(TFDA)授权,开始在台湾对新诊断为GBM患者进行联合放射疗法(RT)及替莫唑胺(TMZ)1期试验。公司计划于2021年下半年在国内开展2期临床试验时进行首例患者给药。目前有3种治疗GBM的靶向药物在中国上市,有7种药物在全球范围内开发。
CAN108 (maralixibat)作为一种新型口服、最低限度吸收的药剂,旨在选择性抑制顶端钠依赖性胆汁酸转运蛋白(ASBT)并治疗罕见的胆汁淤积性肝病,包括Alagille综合症(ALGS)、进行性家族性肝内胆汁淤积症(PFIC)及胆道闭锁(BA)。2021年4月,CAN108(maralixibat)获得Mirum在大中华区开发、制造及商业化运用的独家许可。在全球范围内,目前有2种治疗ALGS的靶向药物、2种治疗PFIC的药物和4种治疗BA的药物正在开发中。
CAN103是中国本土正在开发的针对戈谢病(GD)的ERT,也是北海康成于2018年从药明生物(02269)收购的拥有全球开发和商业化专有权的首个罕见病药物。GD是一种GBA基因突变引发的溶酶体贮积病,2020年中国患病人数达3000人。目前有6种针对GD的靶向药物在美国上市,有7种药物正在全球范围内开发。
CAN106是针对补体C5的创新型、人源化单克隆抗体,用于治疗补体失调的疾病,包括阵发性睡眠性血红蛋白尿(PNH)。北海康成对CAN106拥有全球商业化权利。CAN106也是北海康成和药明生物及Privus Biologics建立战略合作伙伴关系后,共同开发进入临床阶段的罕见病治疗药物。
同时,北海康成的重点临床前候选产品还包括CAN107、CAN105。其中CAN107是中国开发的家族性低磷酸血症佝偻病(XLH)重组人源抗FGF23单克隆抗体,目前处于CMC阶段,为进入IND研究做准备。根据弗若斯特沙利文的数据,此患病率约为1/20,000。
作为用于治疗A型血友病的药物, CAN105是一种重组人源化双特异性抗体,可桥接活化因子IX和因子X以恢复缺失的活化因子VIII的功能。2020年,中国有超过12万名A型血友病患者,且逐年递增。CAN105预计将在2021年下半年进入临床前研究阶段。
此外,北海康成于2019年1月从GC Pharma(或GC)授权引进Hunterase® (CAN101)。Hunterase® (CAN101)是一种用于治疗黏多糖贮积症II型(MPS II)的酶替代疗法,在全球10多个国家销售,并于2012年1月获得MFDS的孤儿药销售许可。截至目前,Hunterase® (CAN101)已获得阿尔及利亚、白俄罗斯、哈萨克斯坦和俄罗斯的销售许可,并已在巴西、埃及、印度、马来西亚、阿曼、土耳其及委内瑞拉批准作为用于治疗MPS II的处方药。Hunterase® (CAN101)也是目前中国唯一可用于MPS II的靶向治疗药物。
在基因疗法领域,sL65为用于基因编辑和基因疗法的下一代嗜肝性的AAV衣壳平台。数据显示,衣壳在人源化小鼠模型和非人类灵长类动物中对人肝细胞进行高效的功能转导,衣壳的可製造性得到改善,对人类血清样品中预先存在的中和抗体更具抵抗力。北海康成使用从 LogicBio Therapeutics 获得许可的 AAV sL65 衣壳载体开发两种基因治疗产品,用于治疗法布里病和庞贝病,并可选择使用相同的载体开发两种额外的适应症和用于治疗的临床阶段基因编辑程序。
财务概况
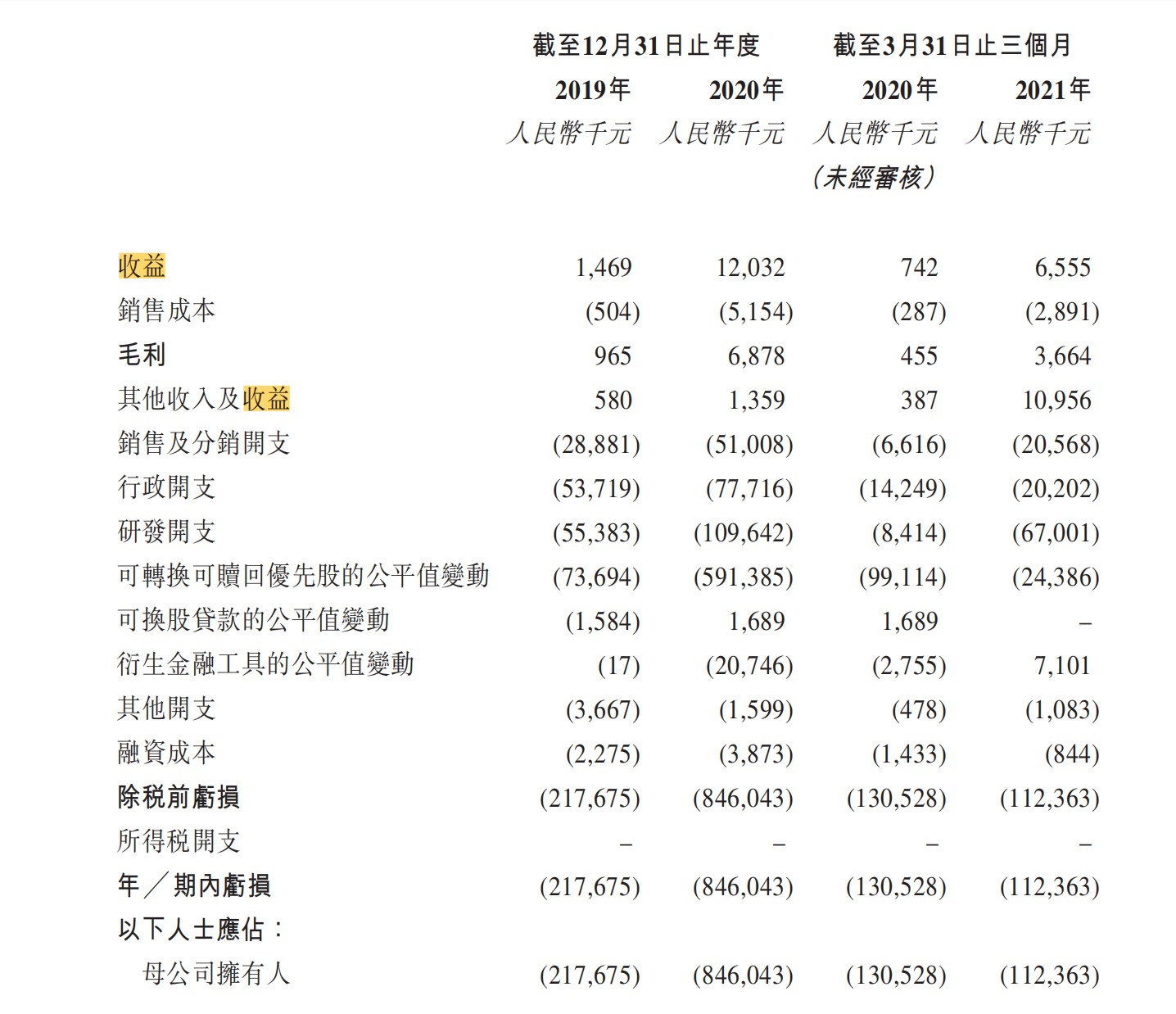
于2019年、2020年截至12月31日止及2020年、2021年截至3月31日止三个月,公司的总收益分别为人民币146.9万元、人民币1203.2万元及人民币74.2万元、人民币655.5万元。毛利润为人民币96.5万元、人民币687.8万元及人民币45.5万元、人民币366.4万元。研发费用分别为人民币5538.3万元、约人民币1.10亿元、人民币841.4万元及人民币6700.1万元。



 扫码下载智通APP
扫码下载智通APP