默沙东(MRK.US)抗新冠特效药加速上市,后来者还能居上吗?
10月1日,默沙东(MRK.US)宣布,公司与Ridgeback Biotherapeutics合作开发的口服抗病毒药物Molnupiravir在对轻度或中度新冠肺炎患者开展的3期研究中,获得积极的期中分析结果,与安慰剂相比,降低患者住院或死亡风险约50%。
基于已经取得的积极临床结果,在独立数据监查委员会的建议下,经与美国食品药品监督管理局(FDA)磋商,默沙东提前终止这项研究的招募工作。同时,公司计划尽快向FDA提交紧急使用授权(EUA)申请,并将向全球多家监管机构提交上市申请。
如果获批上市,Molnupiravir将成为全球首个上市的口服小分子新冠特效药。
受此利好消息刺激,当日默沙东股价大涨8%,创近五年最大单日涨幅。再生元(REGN.US)、Vir Biotechnology(VIR.US)、CureVac(CVAC.US)、Novavax(NVAX.US)、Moderna(MRNA.US)、BioNTech(BNTX.US)等美股新冠中和抗体及疫苗股则全线下跌。
与此同时,受该消息影响,4日港股疫苗股同样出现暴跌,康希诺和复星医药当日分别收跌23%和19%。
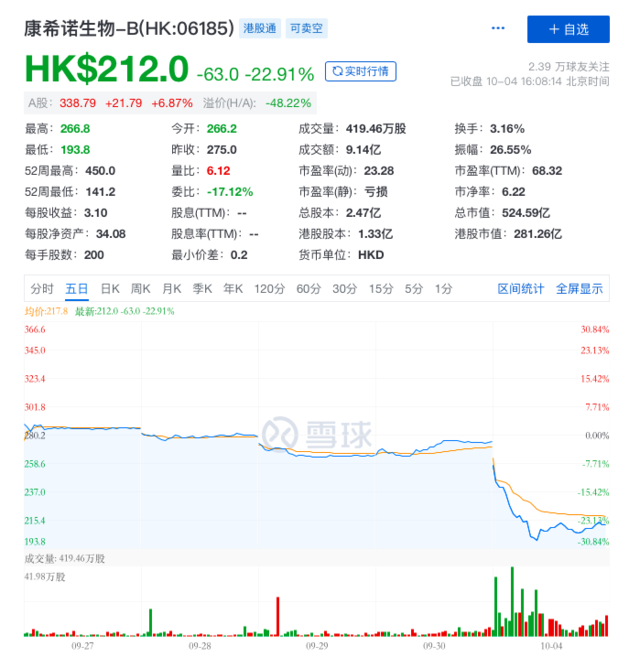

异军突起的Molnupiravir
Molnupiravir的突然走红让人不禁联想到当初吉利德公司的明星抗病毒药物瑞德西韦 (Remdesivir)的大热。
2020年新冠疫情爆发之初,在美国首例新冠病毒确诊病例被曝使用吉利德在研抗病毒新药Remdesivir,病情出现立竿见影的改善后,Remdesivir一下子成为当时公众关注的焦点。
之后,Remdesivir于2020年5月获FDA紧急使用授权(EUA),并在当年10月正式获FDA批准上市,用于治疗12岁及以上、体重至少40公斤的需要住院治疗的成人和儿童新冠患者。
作为目前全球唯一一款正式获批上市用于治疗新冠的小分子药物,Remdesivir在2020年H2实现销售收入28.11亿美元,2021年H1实现销售收入22.85亿美元,显示市场对新冠治疗药物的强烈需求。
不过,Remdesivir只能通过静脉注射给药,仍无法满足治疗中对使用更为便捷的口服抗病毒药物的需求。
对比Molnupiravir和Remdesivir,可以发现这两款药物有很多相同之处,比如两者都属于RNA聚合酶(RdRp)抑制剂,即都以RdRp为作用靶点。新冠病毒是一种RNA病毒,而RNA依赖的RNA聚合酶(RdRps)是RNA病毒遗传物质复制和转录的关键酶,RdRp也因此被认为是抗RNA病毒药物研发最有希望的靶点之一。
另外,这两款药物都是核苷类似物,而核苷类似物和蛋白酶抑制剂被认为是人冠状病毒治疗药物研发的两大潜力方向。
不过,虽然Molnupiravir和Remdesivir都属于核苷类似物,但两者的作用机制却又不尽相同。
其中,Molnupiravir是NHC(β-D-N4-羟基胞苷)前药,在体内经代谢后酯键水解得到NHC。NHC主要是通过给病毒RNA中掺杂大量的碱基A与G,造成病毒遗传信息被“篡改”,从而诱导病毒RNA复制发生突变,以此发挥抗病毒作用。
Remdesivir则是一个磷酰胺酯前药,由母体核苷GS-441524经修饰(磷酸化)而得来,其在体内代谢为三磷酸核苷,结构与天然三磷酸核苷(NTP)相似,但结构上又多了一个CN。因此,在RdRp参与复制RNA的过程中,被RdRp错误地当做普通核苷酸加入了RNA链,但又由于多了一个CN,导致位阻,从而对病毒RNA的复制造成阻碍。
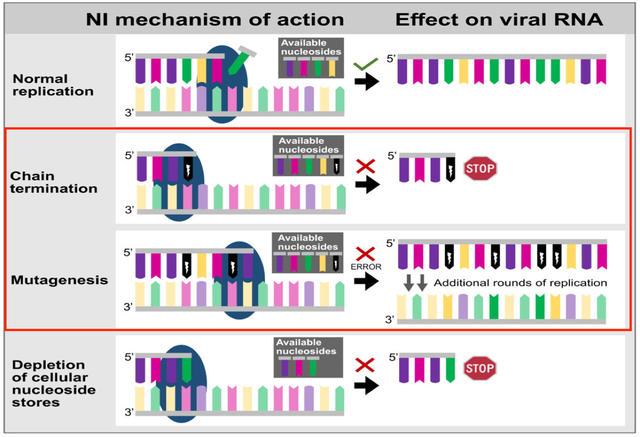
图|核苷酸及核苷类似物的不同抗病毒机制:Molnupiravir是给病毒RNA引入突变,Remdesivir则是对病毒RNA的复制造成位阻
早期的体外临床前研究显示,Molnupiravir比Remdesivir具有更强的抗RNA病毒活性。在Vero细胞系中,Molnupiravir与Remdesivir对新冠病毒的IC50分别为0.3uM与0.77uM,IC50值即达到50%抑制效果时抑制剂的浓度,数值越低说明对病毒的抑制效果越好。并且,Molnupiravir对Remdesivir耐药的冠状病毒仍有效。
所谓“前药”,有来自制药企业的研发人员曾告诉华尔街见闻,当某些具有药理活性的化合物(原药)成药性不够的时候,通过化学结构修饰如加上某种化学基团、片段或分子(载体)后,形成的新化学实体便是前药。前药在体内经酶促或非酶促作用又释放出原药并发挥药理作用。设计前药的目的往往是为了提高药物生物利用度,增加药物稳定性,减小毒副作用等。
值得一提的是,也有多项研究表明,Remdesivir的前药设计可能并非必需,GS-441524作为瑞德西韦的母体核苷和体内代谢物,在临床治疗COVID-19中的作用被大大低估,并具有开发为口服抗COVID-19药物的潜力。
因为直击“痛点”,所以为之“疯狂”
Molnupiravir(MK-4482,,EIDD-2801)并非一个新药,它于2013年诞生于埃默里大学(Emory University)的实验室。研究人员最初将这款药物用于治疗马脑炎病毒感染,但后来在测试中发现,它能够抑制包括SARS-CoV-2(新冠病毒的致病因子)在内的多种RNA病毒的复制。并且,还被证明针对多个新冠病毒分型,SARS和MERS的预防、治疗及阻止病毒传播都具有积极效果。
去年3月,位于迈阿密的Ridgeback Biotherapeutics公司获得了该药的许可。2个月后,默沙东参与进来,从Ridgeback公司手里收购了Molnupiravir的全球权益,双方共同投资开发这款药物。
截至目前,Molnupiravir已开展了三项研究,包括针对住院患者的研究(MOVe-IN)、针对轻中度新冠患者的研究(MOVe-OUT),以及在今年9月初启动的一项代号为MOVe-AHEAD的研究,目的是评估Molnupiravir对暴露后预防的效果。
其中,因为数据不理想,MOVe-IN研究已被停止,而此次引发市场巨震的正是MOVe-OUT3期临床研究披露的期中结果。
据默沙东官方消息,MOVe-OUT是一项全球多中心、随机、双盲、安慰剂对照的3期临床试验研究,受试者为实验室确诊的轻度至中度新冠肺炎非住院成年患者,并在研究随机入组5天内出现症状。所有患者在入组研究时都必须至少具有一项疾病预后不良相关的风险因素。最常见的疾病预后不良风险因素包括肥胖、高龄(>60岁)、糖尿病和心脏病,而这部分人群也被认为是新冠高危人群。
该项3期研究计划招募1550名患者,以1:1的比例随机分为2组,每天2次,口服Molnupiravir(800mg)或安慰剂,为期5天。主要疗效终点是通过对比Molnupiravir组与安慰剂组从随机分组至第29天期间住院和/或死亡的受试者百分比来评估Molnupiravir的疗效。
此次期中分析主要评估2021年8月5日及之前最初入组的775名患者的数据。结果显示,接受Molnupiravir治疗的患者中,有7.3%的患者在随机入组后至第29天期间住院或死亡(28/385),而接受安慰剂的患者的这一比例为14.1%(53/377);P值为0.0012。截至第29天,接受Molnupiravir治疗的患者没有死亡报告,而接受安慰剂的患者有8例死亡。
所有不良事件在Molnupiravir组和安慰剂组中的发生率相当(分别为35%和40%)。同样,药物相关的不良事件发生率也相当(分别为12%和11%)。Molnupiravir组(1.3%)因不良事件而中止研究治疗的受试者少于安慰剂组(3.4%)。
值得一提的是,根据其中40%患者的病毒测序结果,Molnupiravir在不同的病毒变体Gamma、Delta和Mu中显示出一致的疗效。
有不愿意具名的疫苗研发专家向华尔街见闻表示,从3期临床期中分析结果来看,Molnupiravir的突破主要体现在两方面,包括有效降低了病死率,以及无惧变异。
“对于新冠的预防和治疗,大家最关心的还是重症率和病死率。而从目前的临床数据来看,默沙东这个药可以有效阻止接受治疗的轻、中症患者向重症转化,并且没有死亡病例,因此这本身就是一个很好的消息。”对方表示。
“另外,面对突变株,疫苗的保护效率往往会有所下降,而Molnupiravir对不同突变株显示出一致的疗效,这又是一个好消息。”对方说。
Molnupiravir不应是终点
控制新冠疫情,“公卫措施+疫苗预防+药物治疗”往往被认为是完整的抗疫解决方案。
疫苗研发方面,目前全球已有mRNA、灭活、重组蛋白、腺病毒载体等多个技术路径的新冠疫苗获批上市。
在治疗药物方面,也已经有部分药物获FDA批准或者通过紧急使用授权(EUA)的方式用于新冠患者的治疗,包括2个小分子新冠药物—瑞德西韦和巴瑞替尼,3个新冠中和抗体疗法—Casirivimab和Imdevimab联合疗法(再生元)、Bamlanivimab和Etesevimab联合疗法(礼来/君实生物)、Sotrovimab(GSK/Vir Biotechnology),以及抗细胞因子受体抗体托珠单抗。
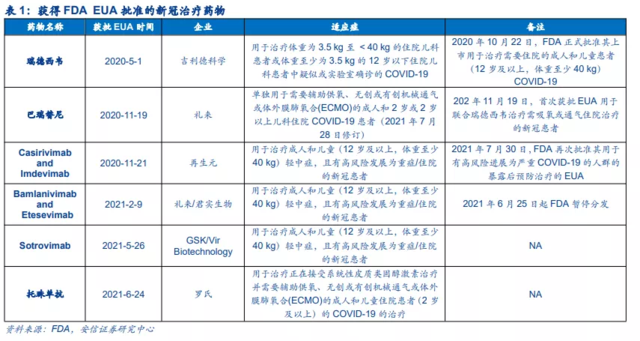
值得注意的是,虽然Molnupiravir超预期的临床表现让市场为之欢欣鼓舞,但其50%的住院/病死率降低幅度其实并不算很高。有研究显示,在类似的高危新冠患者中,早期使用单抗可以降低70%至85%的住院/病死率。
那么,Molnupiravir的突军异起又为何会对中和抗体及疫苗造成冲击?
首先,从适应症来看,目前已获FDA/EUA批准的新冠治疗药物很多是面向重症患者,而Molnupiravir则是用于感染早期的轻、中症患者治疗,避免他们向重症恶化。因此,Molnupiravir可以减少重症患者。
从治疗费用来看,Molnupiravir更为便宜,美国定价约为700美元/人份,是目前中和抗体治疗成本的三分之一。并且,中和抗体需要静脉注射,患者依从性不如口服药物高。
“小分子药物还更容易生产,产能瓶颈小,也方便运输和存储。”还有私募研究员这样肯定了Molnupiravir相较中和抗体疗法的优势。
另一方面,疫苗作为预防手段,将与治疗药物互为补充,两者分别作为第一和第二道防线共同抵御疫情。但是,即便Molnupiravir不能替代疫苗在疫情中的角色,市场仍普遍认为疫苗的投资逻辑也将因Molnupiravir的上市而发生改变。
“随着疫情的发展,已经有越来越多的科学家预测新冠病毒将流感化。而如果参考流感的“疫苗+药物”防治组合,可以看到,疫苗一般是用于老年人或儿童等易感人群的接种,而抗病毒药物的适用人群往往会更广。”前述私募研究员向华尔街见闻表示。
但需要指出的是,由于核糖核苷酸类似物容易进入正常细胞,导致人正常细胞发生基因突变,从而产生癌症等严重副作用。因此,不少人对Molnupiravir可能存在的基因毒性问题还有一定的疑虑,并且类似的风险“可能需要十几年甚至更久才能发现”。
与此同时,Molnupiravir还只能降低50%的重症/病死率,即经过Molnupiravir治疗后的感染组,还有7.3%的患者出现重症。
因此,寻找更有效的抗病毒药物仍然是必需。
据见智研究所统计,除了Molnupiravir以外,目前全球范围内还有多款小分子新冠药物已处于开发后期阶段。在今年Q4,开拓药业的普克鲁胺(AR拮抗剂)、罗氏/Atea Pharmaceuticals的AT-527(RdRp抑制剂)、辉瑞的PF-07321332(蛋白酶抑制剂)预期也将陆续披露数据。
除此之外,国内上市公司中,海正药业、前沿生物等亦有布局新冠治疗药物。
其中,海正药业与日本富山公司联合开发的RdRp抑制剂法维拉韦也处于II期至III期临床研发中。
另外,在今年5月,前沿生物有公告称,公司与中国科学院上海药物研究所达成合作,获得新冠候选新药FB2001(DC系列候选药物)在全球范围内的临床开发、生产、制造及商业化权利。
据前沿生物2021年半年报,目前FB2001正在美国开展I期临床试验。从作用机理看,FB2001和辉瑞PF-07321332一样,属于蛋白酶抑制剂。
君实生物则于10月4日宣布,公司将与旺山旺水生物医药有限公司(下称“旺山旺水”)合作开发口服核苷类抗新冠病毒药物VV116,双方将共同承担VV116在全球范围内的临床开发和产业化工作。
VV116由中国科学院上海药物研究所、中国科学院武汉病毒研究所、中国科学院新疆理化技术研究所、旺山旺水、中国科学院中亚药物研发中心共同研发,并分别向中国和乌兹别克斯坦药品监管部门递交了临床试验申请,其中在乌兹别克斯坦的临床试验申请已获批准。
据君实生物公告,临床前药效学研究显示,VV116在体内外都表现出显著的抗新冠病毒作用。在小鼠模型上,VV116和阳性对照药Molnupiravir都可将肺部病毒滴度降低至检测限以下,二者均表现出较强的抗新冠病毒的功效。并且,临床前的药代动力学等研究结果显示,VV116具有很高的口服生物利用度。
本文选编自“华尔街见闻”,作者:徐红;智通财经编辑:庄礼佳。



 扫码下载智通APP
扫码下载智通APP