辉瑞(PFE.US)18个月内有望获得16项监管批准,哪些最新进展值得关注?
智通财经APP获悉,今日,辉瑞(Pfizer)公司公布了2022年第一季度的财报。在电话会议上,该公司高管着重介绍了COVID-19、炎症和免疫学、传染病、肿瘤学和罕见病领域的重点临床开发项目的最新进展。今天,药明康德内容团队将与读者分享其中精彩内容。

新冠疫苗的最新研发进展
辉瑞和BioNTech联合开发的mRNA疫苗Comirnaty,作为增强针,在5-11岁儿童中显著提高了针对Omicron变种的中和抗体水平。针对Omicron BA.1亚种的中和滴度提高了36倍,对其它Omicron亚种也表现出有效的中和活性。
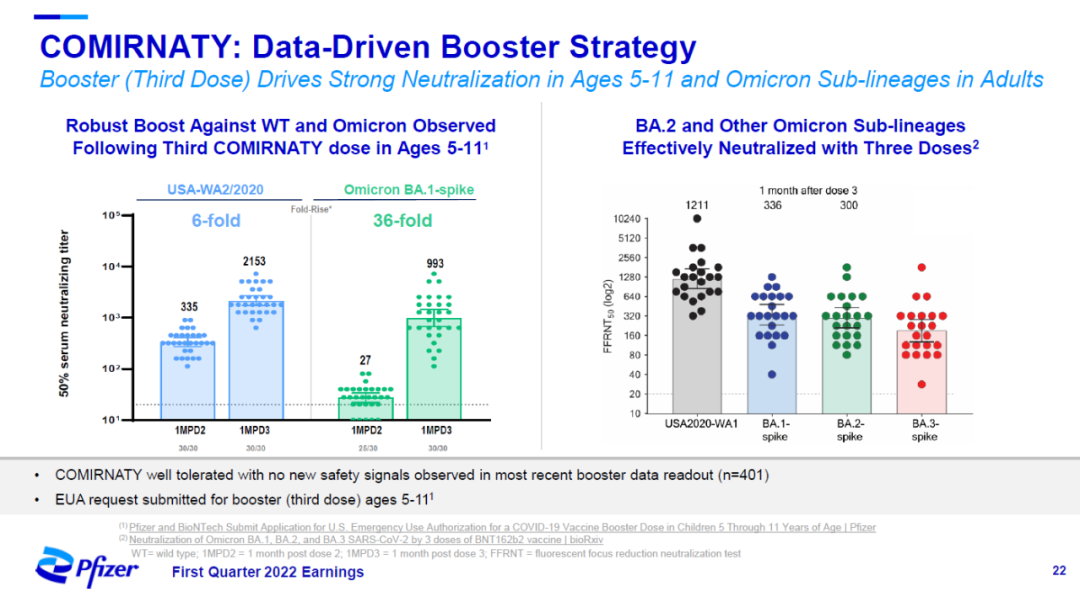
▲Comirnaty增强针在5-11岁儿童中的作用(图片来源:辉瑞官网)
此外,在50岁以上人群中,来自以色列的真实世界数据显示,接种第二剂增强针在Omicron流行的时期显著降低因为COVID-19住院,出现严重疾病,或者死亡的风险。目前,全球超过15个国家已经推荐在高危人群中接种第二剂增强针。
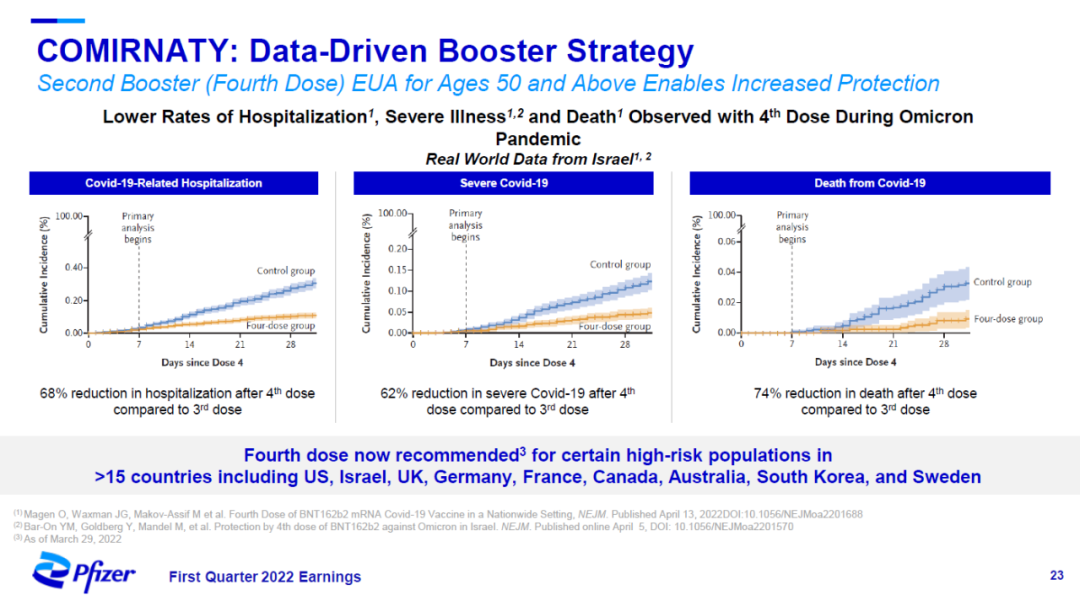
▲Comirnaty第二剂增强针降低50岁以上人群的住院、严重COVID-19、和死亡风险(图片来源:辉瑞官网)
潜在“best-in-class”口服溃疡性结肠炎药物
辉瑞在今年3月11日完成对Arena Pharmaceuticals公司的收购。该公司的主打药物是新一代口服S1P调节剂etrasimod,它可以与与S1P受体1、4、和5特异性结合,可能具有更好的疗效/安全性特征。在治疗中重度活动性溃疡性结肠炎的两项3期临床试验中,etrasimod均达到主要终点和关键次要终点。在接受治疗12周和52周后患者的临床缓解(clinical remission)获得统计显著改善。
辉瑞表示,etrasimod的作用机制具有治疗溃疡性结肠炎以外炎症性疾病的潜力,检验etrasimod治疗克罗恩病、斑秃、特应性皮炎、以及嗜酸性食管炎效果的临床试验均已进入2期临床开发阶段。
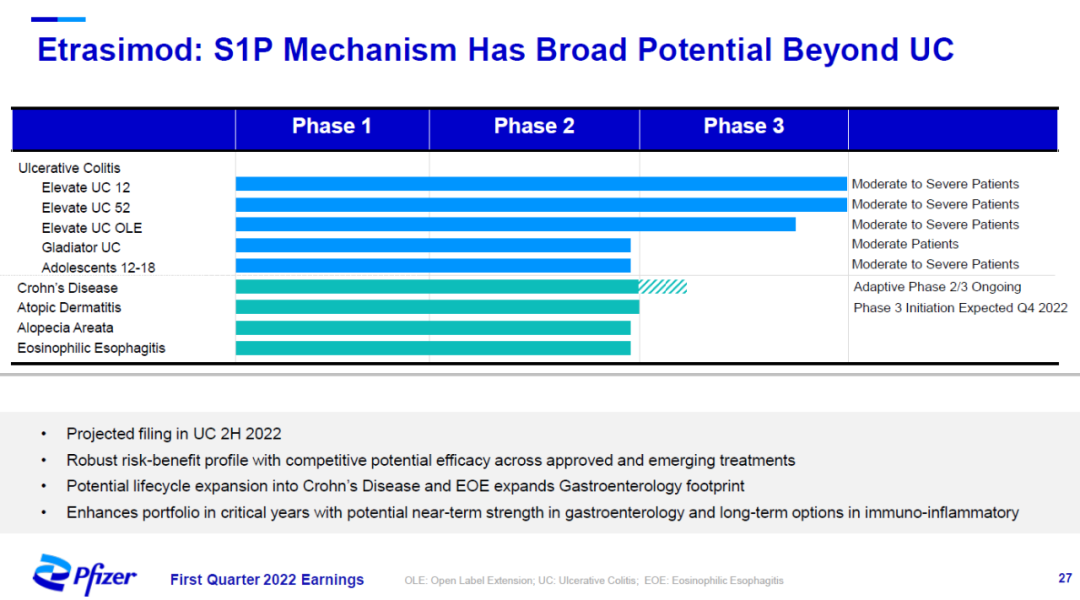
▲Etrasimod的临床开发项目(图片来源:辉瑞官网)
JAK3/TEC选择性抑制剂多项临床试验进展积极
辉瑞的JAK3/TEC选择性抑制剂ritlecitinib的一个特点是避免抑制JAK1、JAK2、和TYK2的活性。这些是已有口服JAK抑制剂的主要靶点,它们在有效治疗炎症性疾病的同时,也带来一些副作用。Ritlecitinib可能在降低药物副作用的同时,仍然抑制广泛免疫炎症疾病的内在驱动因子。在治疗斑秃的3期临床试验中,ritlecitinib已经达到了改善头皮毛发再生的主要疗效终点,在接受治疗6个月后,ritlecitinib组头皮毛发脱落≤20%的患者比例显著高于安慰剂组。该公司预计在今年第二季度递交ritlecitinib治疗斑秃的新药申请(NDA)。

▲Ritlecitinib简介(图片来源:辉瑞官网)
在治疗白癜风的2b期临床试验中,患者接受治疗48周之后,脸部白癜风面积严重指数(F-VASI)获得显著改善。辉瑞预计在今年下半年启动3期临床试验。
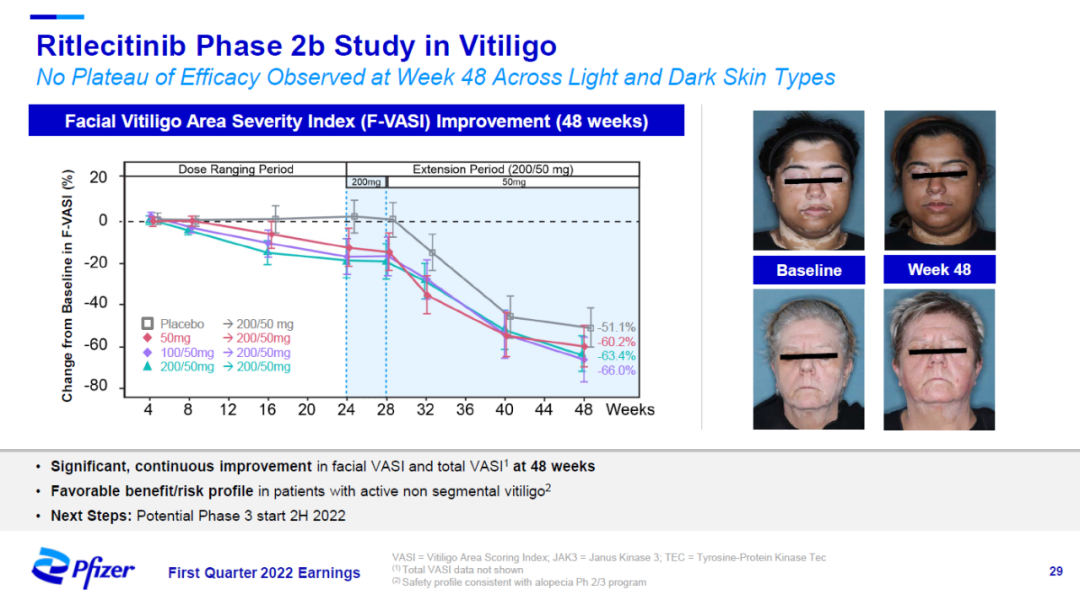
▲Ritlecitinib治疗白癜风的2b期临床试验结果(图片来源:辉瑞官网)
潜在“best-in-class”抗呼吸道合胞病毒疗法
辉瑞近日与ReViral公司达成协议,拟斥资约5.25亿美元收购ReViral,囊获其呼吸道合胞病毒(RSV)疗法sisunatovir。Sisunatovir是一款口服抗RSV药物,通过与RSV的F蛋白结合,阻断RSV与细胞膜的融合,防止病毒感染细胞。在健康志愿者中进行的病毒挑战2期临床试验中,它达到主要终点,显著降低志愿者的病毒载量。这款疗法已经获得美国FDA授予的快速通道资格。
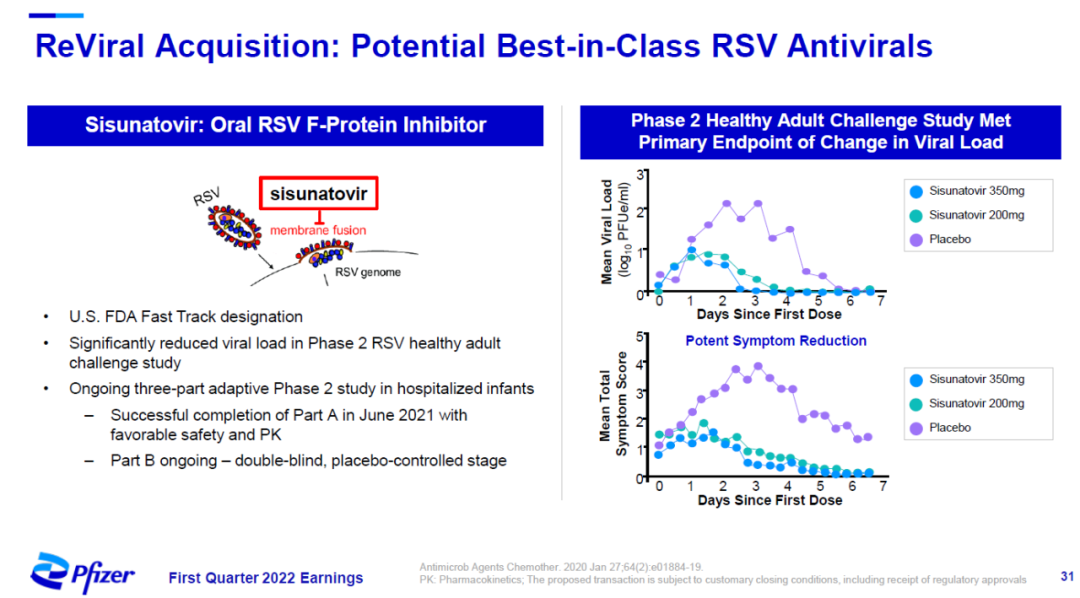
▲Sisunatovir简介(图片来源:辉瑞官网)
治疗非小细胞肺癌,第三代ALK抑制剂3年疗效积极
在近日结束的AACR年会上,辉瑞公布了其第三代ALK抑制剂洛拉替尼(lorlatinib,英文商品名Lorbrena)的3年随访结果。试验结果显示,与活性对照组相比,洛拉替尼将患者疾病进展或死亡风险降低73%。这款疗法近日也在中国获得监管批准,用于治疗ALK阳性局部晚期或转移性非小细胞肺癌。
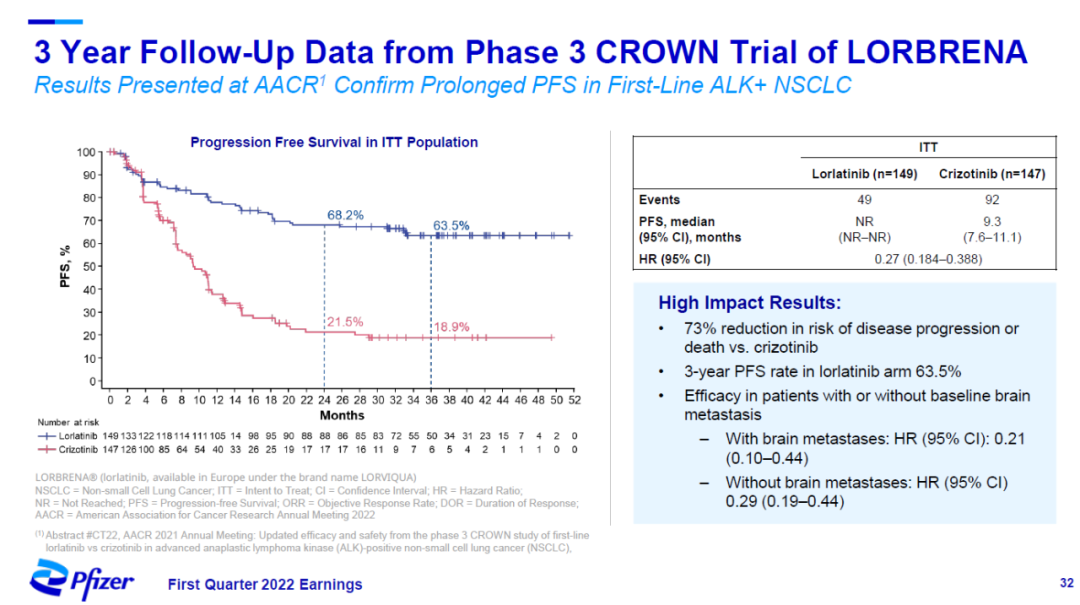
▲洛拉替尼显著降低患者疾病进展或死亡风险(图片来源:辉瑞官网)
洛拉替尼由于能够穿越血脑屏障,因此在预防脑转移瘤的产生方面也显示出良好的效果。3年随访结果显示,在意向治疗患者中,与活性对照相比,洛拉替尼将出现脑转移瘤的风险降低92%。
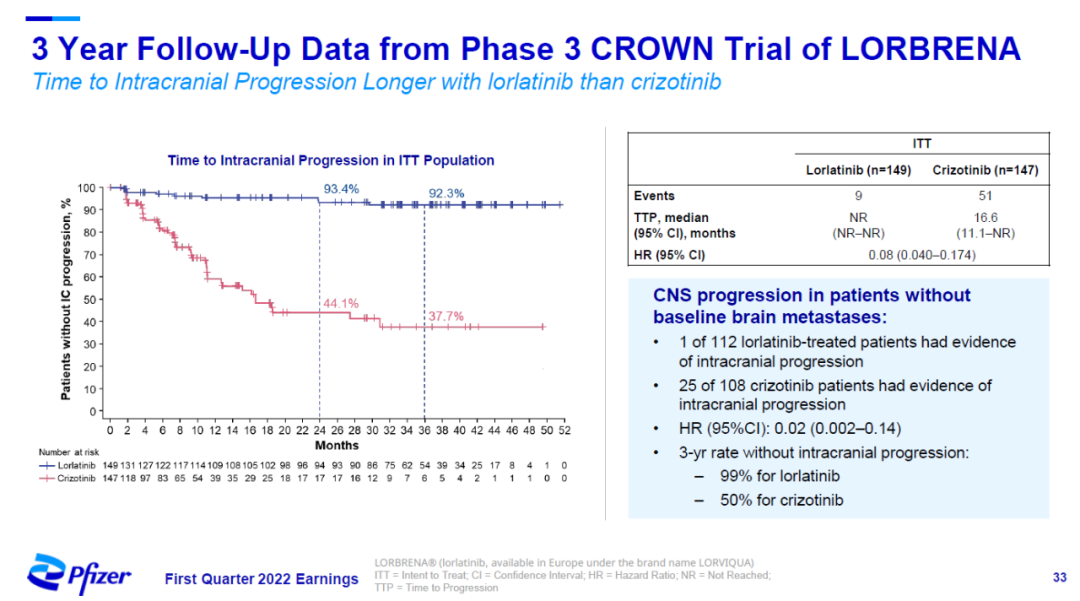
▲洛拉替尼显著降低癌症脑转移风险(图片来源:辉瑞官网)
多种策略治疗覆盖所有血友病类型
在治疗血友病方面,辉瑞治疗血友病B的基因疗法在1b/2期临床试验中表现出积极疗效,在接受治疗后随访时间为3-5.5年时,患者的平均年出血率在0.1~0.9之间。这款疗法将在2023年第一季度获得关键性临床试验结果。该公司治疗血友病A的基因疗法获FDA放行,预计在今年第三季度重启关键性临床试验。
此外,该公司开发的marstacimab是一款不直接靶向凝血因子的候选疗法,它是一款靶向组织因子通路抑制剂(TFPI)的单克隆抗体。TFPI是一种抗凝血蛋白,靶向抑制TFPI的功能给血友病A和B患者提供一种新的皮下注射预防疗法,不管他们体内是否存在针对凝血因子的抗体。

图片来源:辉瑞官网
辉瑞公司表示,预计在未来18个月里,可获得高达16项监管批准,高达19项关键性临床试验结果,以及高达15项概念验证试验结果。
本文编选自公众号“药明康德”,智通财经编辑:丁婷。



 扫码下载智通APP
扫码下载智通APP