再鼎医药(ZLAB.US)CD20xCD3双特异性抗体在中国申报临床
作者:
智通财经 李国坚
2020-07-03 14:30:22
根据中国国家药监局药品审评中心公示,再鼎医药与再生元共同申报的REGN1979注射液的5项临床申请已获得受理。
智通财经APP获悉,7月3日,根据中国国家药监局药品审评中心公示,再鼎医药(ZLAB.US)与再生元(REGN.US)共同申报的REGN1979注射液的5项临床申请已获得受理。
据悉,REGN1979是一款CD20xCD3双特异性抗体,再鼎医药于今年4月以高达1.9亿美元的金额从再生元引进,获得了其在大中华区的开发和独家商业化权益。此次申报临床并获受理,是双方宣布合作后取得的新进展。
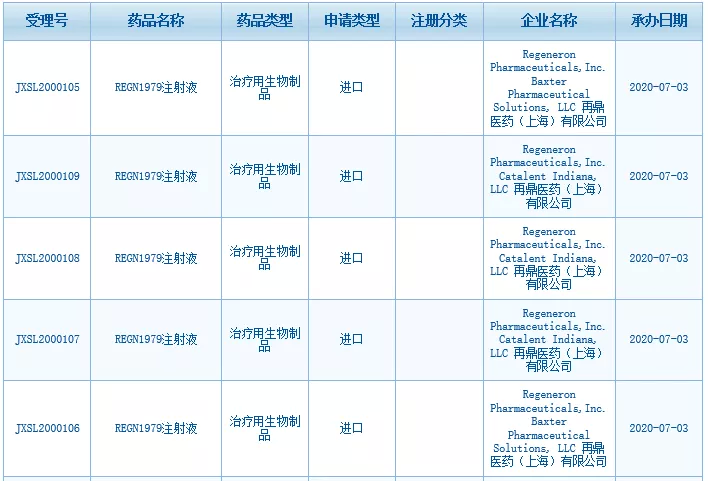
图片来源:CDE官网截图
REGN1979是通过再生元双特异性抗体平台开发的一款双特异性单克隆抗体,旨在通过与B细胞肿瘤蛋白(CD20)和免疫系统T细胞受体(CD3)结合来杀伤癌细胞。早前,REGN1979已被美国FDA授予孤儿药资格,用于治疗弥漫性大B细胞淋巴瘤(DLBCL)和滤泡性淋巴瘤(FL)。在全球,REGN1979正在晚期滤泡性淋巴瘤、弥漫性大B细胞淋巴瘤和其它淋巴瘤患者中开展多项临床研究。
智通声明:本内容为作者独立观点,不代表智通财经立场。未经允许不得转载,文中内容仅供参考,不作为实际操作建议,交易风险自担。更多最新最全港美股资讯,请点击下载智通财经App
相关阅读
年内涨幅近100% 欲回港二次上市的再鼎医药(ZLAB.US)魅力几何?
2020-07-02 17:12
聂一洲
新股消息 | 传再鼎医药(ZLAB.US)酝酿赴港上市 今年股价拉升97.5%市值逾400亿港元符合第二上市标准
2020-07-02 09:13
李程
Dupixent凭什么能卖100亿欧元?赛诺菲(SNY.US)公布详细开发计划
2020-06-12 09:05
医药魔方
再生元(REGN.US)启动鸡尾酒疗法REGN-COV2首个临床试验 用于治疗和预防COVID-19
2020-06-12 08:19
李国坚
再生元(REGB.US)将用于应对公共卫生事件的混合型抗体投入临床试验
2020-06-11 20:22
孙健一




 扫码下载智通APP
扫码下载智通APP