CAR-T细胞治疗管线踏出IND获批第一步 永泰生物-B(06978)中长期投资价值尽显
公司的投资价值不仅体现在对创新管线的持续投入上,还体现在产品开发的关键性节点上。
身为国内在细胞免疫治疗领域的“独角兽”,一直以来,永泰生物在扩增活化的淋巴细胞(EAL®)和CAR-T细胞领域等方面的研究、开发都在国内保持相对领先的状态。此次公司CAR-T系列候选产品CAR-T-19注射液IND申请获批,便是其走向国内商业化的第一步。
12月28日,永泰生物-B(06978)正式宣布,公司经基因改造、表达抗CD19嵌合抗原受体("CAR-T-19")的T细胞并且作为集团管线产品之一的CAR-T-19注射液,已获得国家药品审评中心批准新药临床试验("IND")申请,可进行临床试验。公司预期CAR-T-19的临床试验将在2021年展开。

智通财经APP了解到,CAR-T-19对应的适应症为B细胞急性淋巴细胞白血病("B-ALL")及B细胞淋巴癌。
急性淋巴细胞白血病("ALL")是急性白血病的亚型之一,其特征为未成熟血细胞数量快速增加,其中血细胞的DNA突变,并且不能生长成为正常细胞。ALL主要分为T细胞系和B细胞系两大类。从病患人群分类来看,ALL的儿童患者较成人患者更为常见;从病患比例来看,其中B-ALL占75%,T-ALL占25%。
在一项由英联邦医学研究委员会(MRC)和美国东部肿瘤协作组(ECOG)联合发起的研究中,研究者发现,ALL患者的复发率和生存率与年龄以及使用化疗密切相关。
研究结果表明,ALL患者生存率会随着年龄的增加而显著降低,但在0-22岁的人群中,10-20%的新确诊患者对标准疗法化疗无效。而使用化疗方案的ALL患者在接受了长期治疗后,5年的生存率和5年缓解持续时间都会降至40%以下。
就中国而言,目前国内针对ALL患者的治疗多数还是以化疗为主。尤其在儿童患者中,如何降低复发率、提高生存期,已成为了临床治疗的一大难点。
数据显示,2015年中国约有12000名新增的B-ALL患者,当中难治复发的病例占30%。新增的ALL患者人数由2014年约11600人增至2018年约12400人。2018年,中国约有10700名18岁以下儿童新增患上ALL,占于中国的ALL患者总数86.3%。由于早期筛查的发展,估计2023年将达到13400例,2030年将达到14700例。
为满足庞大的治疗需求,永泰生物的CAR-T-19瞄准了B细胞急性淋巴细胞白血病("B-ALL")及B细胞淋巴癌适应症。
智通财经APP了解到,CAR-T-19注射液的功能成分为经基因改造、表达抗CD19嵌合抗原受体的T细胞。活化的CAR-T-19细胞可识别并直接杀伤表达CD19分子的肿瘤细胞。
与同类产品Kymriah对比,永泰生物的CAR-T-19在安全性及有效性方面均有更为良好的表现。在研究人员发起的临床研究中,有63名患者接受治疗,其客观反应率达98.21%,同时CRS反应小,安全性数据良好。
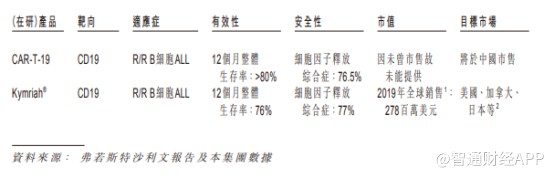
作为在适应症方面与CAR-T-19相同的唯一CAR-T市售产品,诺华的Kymriah®当前并未在中国市场销售,并且由于国内暂时也没有同类产品开始临床试验,所以已踏出IND第一步的CAR-T-19俨然是业内的领跑产品。
参考诺华Kymriah®的销售情况,Kymriah®在2017-2019年的全球销售分別为600万美元、7600万美元和2.78亿美元,复合增长率达到580.7%,显示出了极大的收入增长潜力。
值得一提的是,慢病毒载体成本于生产CAR-T细胞产品中占整体生产成本约1/3。永泰生物是自行为CAR-T-19在研产品研发生产慢病毒载体,与外购相比,既显著降低了CAR-T-19在研产品的生产成本,又将核心技术和生产环节掌握在了自己手中。因此有理由相信,待CAR-T-19产品上市后,永泰生物将拥有良好的收入前景,增厚公司的利润。
实际上,CAR-T-19只是永泰生物创新研发的一个缩影。除了CAR-T-19外,永泰生物还拥有一款核心候选产品EAL®,并布局了全面的细胞免疫治疗研发管线,充分说明了公司创新研发的高效。
据智通财经APP了解,除CAR-T-19获临床实验许可外,永泰生物在对实体瘤的细胞免疫治疗领域早已跑在了前列。其核心在研产品EAL是中国首款、也是目前为止唯一一款获准进入II期临床试验的实体瘤细胞免疫治疗产品。由于目前没有同类产品开始临床试验,因此作为研发进度最快的药物,EAL至少在上市5年之内不会有竞争对手,公司先发优势之大可见一斑。
公司在扩增活化的淋巴细胞(EAL®)和CAR-T细胞领域均取得显著的研发进展,资本市场对此也有积极的反馈。
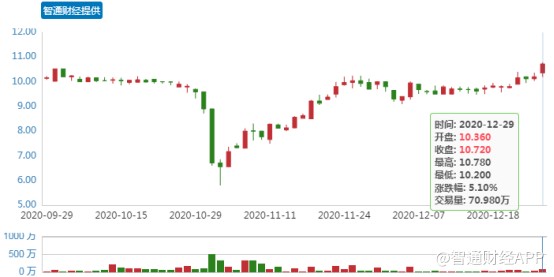
12月29日,永泰生物股价高开高走,截至午盘,公司盘中股价最高达到每股10.78港元,创下近2个月来新高。并且自今年11月以来,永泰生物的股价都在稳步增长,区间股价最高涨幅已达到85.9%。而这也反映出,随着创新管线研发持续推进,永泰生物的成长确定性正在不断提高。



 扫码下载智通APP
扫码下载智通APP