安进(AMGN.US)单抗Tezepelumab递交BLA,用于治疗重度哮喘
作者:
智通财经 魏昊铭
2021-05-11 20:29:32
5月10日,安进宣布公司合作伙伴阿斯利康已向美国 FDA 提交了 Tezepelumab 的生物制剂许可申请(BLA)。
据智通财经APP获悉,5月10日,安进(AMGN.US)宣布公司合作伙伴阿斯利康(AZN.US)已向美国 FDA 提交了 Tezepelumab 的生物制剂许可申请(BLA)。据了解,Tezepelumab 是一款靶向并阻断胸腺基质淋巴细胞生成素(TSLP)的潜在 first-in-class 药物,用于治疗重度哮喘 。
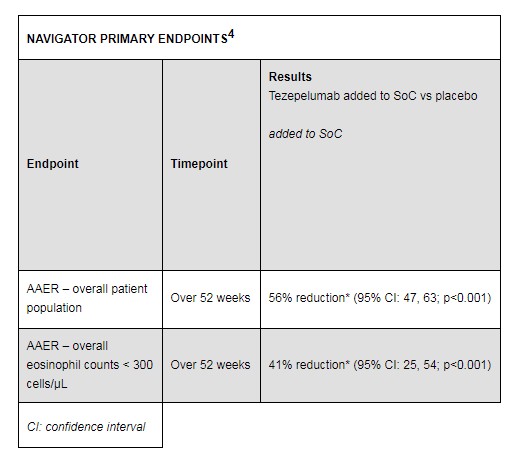
本次BLA 是基于 PATHFINDER 临床试验阳性结果的支持,包括关键性3期临床 NAVIGATOR。该试验结果显示,与安慰剂相比, Tezepelumab 在降低重度、不受控制的哮喘患者的年平均哮喘急性发作率(AAER)上具有统计学和临床意义。在 2 期和 3 期临床试验中,不论基线嗜酸性粒细胞计数多少,不论患者表型或 T2 生物标志物状态,Tezepelumab 是唯一能够持续显着降低广泛重度哮喘患者 AAER 的生物制剂。Tezepelumab最常见的不良反应是鼻咽炎、上呼吸道感染和头痛。
NAVIGATOR 是第一个通过靶向 TSLP 对严重哮喘有治疗益处的 III 期试验,在广泛的严重哮喘患者群体中,tezepelumab 使重度哮喘患者的 AAER 显著降低,包括嗜酸性粒细胞计数低的患者群体中,具体数据如下:
智通声明:本内容为作者独立观点,不代表智通财经立场。未经允许不得转载,文中内容仅供参考,不作为实际操作建议,交易风险自担。更多最新最全港美股资讯,请点击下载智通财经App
相关阅读
港股开盘(5.11)︱恒指跌1.08% 荣昌生物-B(09995)早盘高开2.02% 拟申请在科创板上市
2021-05-11 09:25
庄东骐
中泰国际:拜登关于疫苗专利的提案的短期影响有限
2021-05-10 15:51
中泰国际
港股开盘(5.10)︱恒指涨0.58% 复星医药(02196)高开近15% 与BioNTech拟就新冠疫苗产品的本地化生产及商业化设立合资公司
2021-05-10 09:24
庄东骐
中金:医药、新能源行业多只股票或将纳入沪深300指数
2021-05-07 09:04
中金研究
全球十大畅销药洗牌!三个重磅品种出局,O药大下滑!
2021-05-07 07:39
智通编选



 扫码下载智通APP
扫码下载智通APP