赛诺菲(SNY.US)度普利尤单抗在中国获批新适应症
作者:
智通财经 刘岩
2021-09-09 18:12:10
今日,中国国家药监局(NMPA)最新公示,赛诺菲(SNY.US)在中国提交的度普利尤单抗注射液(dupilumab,英文商品名Dupixent)新适应症上市申请,已正式获得批准。
智通财经APP获悉,今日,中国国家药监局(NMPA)最新公示,赛诺菲(SNY.US)在中国提交的度普利尤单抗注射液(dupilumab,英文商品名Dupixent)新适应症上市申请,已正式获得批准。根据NMPA药品审评中心(CDE)优先审评公示,该适应症针对12岁及以上青少年和成人中重度特应性皮炎患者。这些患者的症状在接受外用处方药后仍控制不佳,或者不建议使用外用处方药。

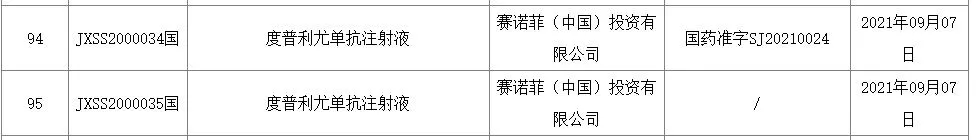
截图来源:NMPA官网
公开资料显示,度普利尤单抗由赛诺菲和再生元(Regeneron)联合开发,是一款可同时抑制白介素-4(IL-4)和白介素-13(IL-13)的单抗,也是全球首个获得美国FDA及欧盟EMA批准治疗中重度特应性皮炎的靶向生物制品。根据赛诺菲财报,度普利尤单抗2020年的全球销售额已超过35亿欧元,可见该药临床需求之大。
在中国,度普利尤单抗是临床急需境外新药之一,已在2020年6月获批用于治疗成人中重度特应性皮炎,并已被纳入了2020年版中国国家医保目录。
2020年9月和2021年5月,赛诺菲先后两次在中国递交度普利尤单抗的新适应症上市申请,分别针对12岁及以上青少年和成人中重度特应性皮炎患者,以及6岁及以上且小于12岁的儿童和成人中重度特应性皮炎患者。值得一提的是,这两次上市申请均已被CDE纳入优先审评。
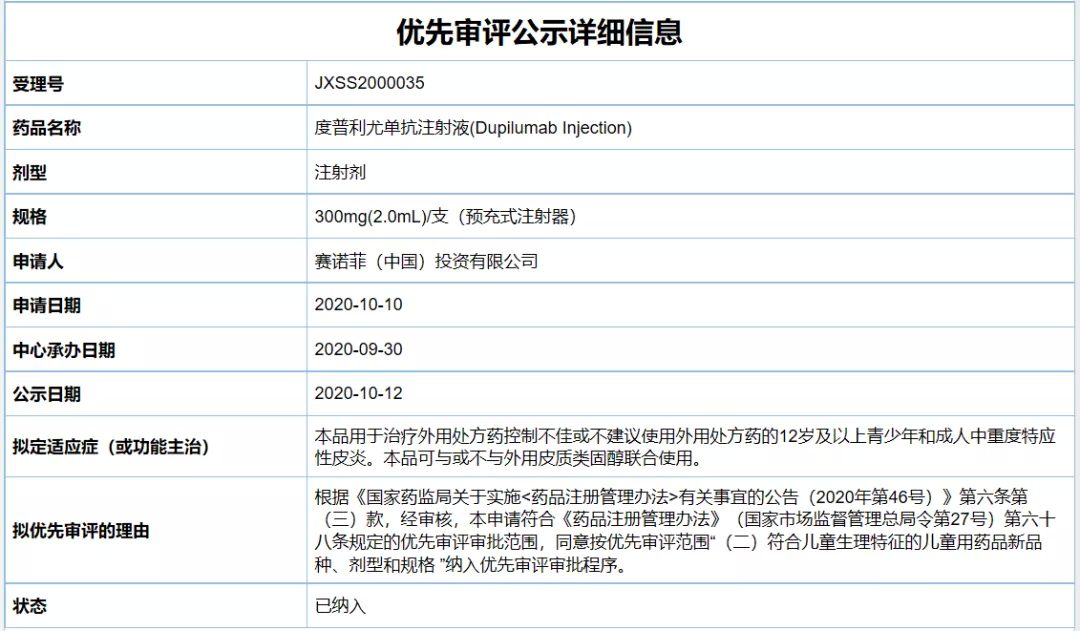
截图来源:CDE官网
智通声明:本内容为作者独立观点,不代表智通财经立场。未经允许不得转载,文中内容仅供参考,不作为实际操作建议,交易风险自担。更多最新最全港美股资讯,请点击下载智通财经App
相关阅读
美股异动 | 生物制药公司Kadmon(KDMN.US)盘前涨近77%,获赛诺菲(SNY.US)溢价收购
2021-09-08 16:11
马火敏
赛诺菲(SNY.US)将以19亿美元收购美国生物制药公司Kadmon(KDMN.US)
2021-09-08 15:08
马火敏
赛诺菲(SNY.US)新冠疫苗遭遇挫折,新药研发管线仍然困难重重
2021-08-05 16:09
赵锦彬
Translate Bio(TBIO.US)盘后涨超68%,传将被赛诺菲(SNY.US)收购
2021-08-03 07:37
庄礼佳
赛诺菲(SNY.US)葛兰素史克(GSK.US)新冠疫苗获批在印开展后期临床试验
2021-07-08 21:11
陈诗烨



 扫码下载智通APP
扫码下载智通APP